13.6: Aplicaciones de los equilibrios ácido-base
- Page ID
- 70656
Asegúrese de comprender a fondo los siguientes conceptos esenciales:
- Describir las principales características del ciclo global del carbono y describir el papel de los procesos ácido-base tanto en las partes lentas como rápidas del ciclo.
- Describir las principales reacciones ácido-base en la respiración aeróbica.
- Definir la lluvia ácida, y explicar sus orígenes. Resumir sus principales efectos sobre el medio ambiente.
Las reacciones ácido-base penetran en todos los aspectos de la química industrial, fisiológica y ambiental. En esta unidad tocamos algunos puntos destacados que cualquier persona que estudie o practique la ciencia química debe conocer.
Algunas aplicaciones de los búferes
Las soluciones tampón y el efecto tampón que producen son extremadamente importantes en muchas aplicaciones prácticas de la química. La razón de esto es que muchos procesos químicos son bastante sensibles al pH; la extensión de la reacción, su velocidad, e incluso la naturaleza de los productos pueden alterarse si se permite que el pH cambie. Tal cambio tenderá a ocurrir, por ejemplo, cuando la reacción en cuestión, o una reacción paralela no relacionada, consume o libera iones hidrógeno o hidróxido.
Tampones en bioquímica y fisiología
Muchas reacciones que tienen lugar en los organismos vivos entran dentro de esta categoría. La mayoría de los procesos bioquímicos son catalizados por enzimas cuyas actividades son altamente dependientes del pH; si el pH local se desvía demasiado del valor óptimo, la enzima puede quedar permanentemente desactivada.
- Por ejemplo, la oxidación de la glucosa a dióxido de carbono y agua —el proceso fundamental de producción de energía del metabolismo aeróbico— libera iones H +. Las múltiples etapas de este proceso son catalizadas por enzimas cuya actividad se ve fuertemente afectada por el pH. Si la región de la célula donde tienen lugar estas reacciones no estuviera tamponada, el acto mismo de vivir pronto reduciría el pH local por debajo del rango en el que las enzimas están activas, deteniendo la producción de energía y matando a la célula.
- La sangre está fuertemente tamponada (principalmente por bicarbonato) para mantener su pH a 7.4±0.3; valores de pH por debajo de 7.0 o por encima de 7.8 causan la muerte en minutos.
- Los interiores de la mayoría de las células están tamponados cerca de pH 7.0 (por fosfatos y proteínas)
Tampones en la industria
Los tampones se emplean en una amplia variedad de procedimientos de laboratorio y procesos industriales:
- soluciones para la calibración de medidores de pH
- crecimiento de bacterias en medios de cultivo
- procesos de fermentación, incluida la elaboración del vino y la elaboración de cerveza
- controlar los colores de los tintes utilizados en la coloración de telas
- champús (manteniendo el pH a o por debajo de 7 para conteraccionar la alcalinidad de los jabones que pueden causar irritación)
- otros productos de cuidado personal como lociones para bebés (manteniendo el pH alrededor de 6 para inhibir el crecimiento de bacterias)
- Control del pH en tintas de impresión para asegurar su correcta penetración en el papel
Búferes en el entorno
- Las aguas naturales (lagos y arroyos) capaces de soportar la vida acuática son amortiguadas por los sedimentos con los que están en contacto. Este amortiguamiento no siempre es capaz de compensar los efectos de la lluvia ácida.
- El agua de mar está tamponada principalmente con bicarbonato y boratos. Esto permite que los océanos absorban aproximadamente la mitad del CO 2 emitido a la atmósfera por las actividades humanas.
- Los suelos, para mantenerse productivos, deben mantener un pH casi neutro, no solo para las plantas sino también para los microorganismos que fijan y reciclan nitrógeno. Los suelos que se vuelven altamente ácidos por la lluvia ácida pueden mantener nutrientes esenciales como los fosfatos en formas como el Ca 3 (PO 4) 2 insoluble que impide su absorción por las plantas.
Química ácido-base en fisiología
La química ácido-base juega un papel crucial en la fisiología, tanto a nivel de la célula individual como del organismo total. Las razones de esto son dos:
- Muchos de los principales componentes químicos de un organismo pueden actuar por sí mismos como ácidos y/o bases. Así, las proteínas contienen grupos tanto ácidos como básicos, de manera que sus formas y sus actividades funcionales son altamente dependientes del pH.
- Prácticamente todos los procesos metabólicos importantes implican la captación o liberación de iones de hidrógeno. El acto mismo de estar vivo tiende a cambiar el pH circundante (generalmente reduciéndolo); esto eventualmente matará al organismo en ausencia de mecanismos Budering.
Alrededor de dos tercios del peso de un humano adulto consiste en agua. Alrededor de dos tercios de esta agua se localiza dentro de las células, mientras que el tercio restante consiste en agua extracelular, en su mayoría líquido interstial que baña las células, y el plasma sanguíneo. Este último, que asciende aproximadamente al 5% del peso corporal (aproximadamente 5 L en el adulto), sirve como líquido de soporte para las células sanguíneas y actúa como medio de transporte de sustancias químicas entre las células y el ambiente externo. Se trata básicamente de una solución 0,15 M de NaCl que contiene cantidades menores de otros electrolitos, los más importantes de los cuales son HCO 3 — y aniones proteicos.
La respiración, la actividad fisiológica más importante de una célula, es un proceso productor de ácido. Las sustancias de carbohidratos se descomponen en dióxido de carbono y, por lo tanto, en ácido carbónico:
\[C(H_2O)_{n} + O_2 → CO_2 + n H_2O\]
Mantenimiento del equilibrio ácido-base
Es notable que el pH de la mayoría de los fluidos celulares pueda mantenerse dentro de un rango tan estrecho, dada la gran cantidad de procesos que tienden a alterarlo. Esto se debe al exquisito equilibrio entre una gran cantidad de procesos interconectados que operan en muchos niveles diferentes. El equilibrio ácido-base en el cuerpo se mantiene por dos mecanismos generales: la excreción selectiva de ácidos o bases, y por la acción amortiguadora de los sistemas ácido-base débiles en los fluidos corporales.
- En un periodo de 24 horas, el humano adulto elimina el equivalente a alrededor de 20-40 moles de H + por vía de los pulmones en forma de CO 2. Además, los riñones excretan quizás el 5% de esta cantidad de ácido, principalmente en forma de H 2 PO 4 — y
NH 4 +. Debido a sus cargas eléctricas, estas dos especies están estrechamente ligadas al equilibrio salino con iones como Na + o K + y Cl —. - El principal sistema de tamponamiento en el cuerpo es el sistema de carbonato, que existe principalmente en forma de HCO 3 — a pH fisiológico normal. La acción amortiguadora secundaria proviene de los fosfatos, de las proteínas y otros ácidos orgánicos débiles, y (dentro de las células sanguíneas), de la hemoglobina.
Existe una enorme industria dirigida al mercado de la “salud alternativa” notoriamente desafiada por la ciencia que promueve las nostrumas inservibles como el “agua ionizada” que se afirma restablecen o preservan “el equilibrio ácido-base del cuerpo”. Comúnmente señalan que la mayoría de los alimentos son “ácidos”, (es decir, se metabolizan a H 2 CO 3), pero nunca explican que la mayor parte de este ácido es casi exhalado inmediatamente en forma de CO 2. La implicación es que nuestra salud está siendo arruinada por la resultante “acidificación” del cuerpo; algunos implican además que esto puede ser causa de cáncer y otras dolencias surtidas.
Las personas que caen en estas costosas estafas están en efecto pagando un impuesto sobre la ignorancia científica. Quienes, como tú, han estudiado Química, deben considerar que tienen el deber social de contrarrestar este tipo de pseudociencia depredadora y engañosa.
Alteraciones del equilibrio ácido-base
Las desviaciones del pH del plasma sanguíneo de su valor normal de 7.4 en más de aproximadamente ±.1 pueden ser muy graves. Estos padecimientos se conocen médicamente como acidosis y alcalosis. Pueden ser causadas por alteraciones metabólicas como la diabetes y por insuficiencia renal en la que se inhibe la excreción de H 2 PO 4 —por ejemplo ,—.
Numerosos otros procesos conducen a desequilibrios temporales. Así, la hiperventilación, que puede ser el resultado del malestar emocional, conduce a una pérdida de CO 2 por encima de lo normal, y por lo tanto a la alcalosis. De igual manera, la hipoventilación puede actuar como un mecanismo compensatorio para la acidosis. Por otro lado, la retención de CO 2 causada por bronconeumonía, por ejemplo, puede dar lugar a acidosis. La acidosis también puede ser el resultado de la diarrea (pérdida de líquido alcalino del intestino), mientras que la pérdida del contenido gástrico por el vómito promueve la alcalosis.
Lluvia ácida
La atmósfera es naturalmente ácida
La atmósfera natural no contaminada recibe sustancias ácidas, básicas y neutras de fuentes naturales (emisiones volcánicas, niebla salina, polvo soplado por el viento y metabolismo microbiano) así como de la contaminación (Figura 11.6.X). Estos reaccionan en una especie de gigantesca titulación ácido-base para dar una solución en la que deben predominar los iones hidrógeno para mantener el equilibrio de carga (indicado por las anchuras idénticas de las gráficas de barras en la parte inferior etiquetadas como “aniones” y “cationes”).
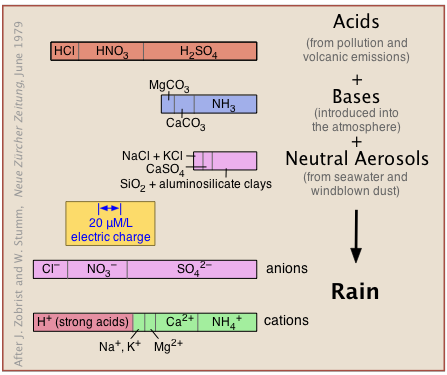
Sin embargo, el dióxido de carbono es la principal fuente de acidez en la atmósfera no contaminada. Como se explicará más adelante, el CO 2 constituye 0.032% vol-% del aire seco, y se disuelve en agua para formar ácido carbónico:
\[CO_{2(g) }+ H_2O(l) \rightleftharpoons H_2CO_{3(aq)}\]
Así, toda la lluvia es “ácida” en el sentido de que contiene CO 2 disuelto lo que reducirá su pH a 5.7. Por lo tanto, el término lluvia ácida se entiende como lluvia cuyo pH está controlado por contaminantes que pueden bajar el pH en el rango de 3-4, resultando en daños severos al medio ambiente.
Origen de la lluvia ácida
La lluvia ácida se origina a partir de las emisiones de SO 2 y diversos óxidos de nitrógeno (conocidos colectivamente como “NO x “) que se forman durante los procesos de combustión, especialmente los asociados con la quema de carbón. La incineración de desechos, las operaciones industriales como la fundición y los incendios forestales son otras fuentes relacionadas con la combustión; estos también liberan material particulado a la atmósfera que juega un papel importante en la concentración y distribución de estas sustancias formadoras de ácido.
Orígenes de NO x
Los óxidos de nitrógeno son formados de forma natural por bacterias del suelo que actúan sobre los iones nitrato, un nutriente esencial de la planta y en sí mismo un producto de la fijación El amoníaco, producto de la descomposición bacteriana de la materia orgánica, es finalmente transformado en NO 3 — por bacterias en óxidos de nitrógeno.
La cantidad de nitrógeno fijo producido industrialmente para apoyar la agricultura intensiva ahora supera la cantidad formada naturalmente, y se ha convertido en la principal fuente de óxidos de nitrógeno antropogénicos.
- El nitrógeno atmosférico puede descomponerse térmicamente a sus diversos óxidos NO x cuando se somete a altas temperaturas; una fuente natural menor es el rayo. Más significativamente, estos óxidos también se forman cuando los combustibles “limpios” como el gas natural (principalmente metano, CH 4) se queman en el aire.
- NO x también puede reaccionar con otros contaminantes atmosféricos para producir smog fotoquímico.
Formación de ácidos
Los gases señalados anteriormente reaccionan con el oxígeno atmosférico, entre sí, y con materiales particulados para formar ácidos sulfúrico, nítrico y clorhídrico.
- La mayor parte del H 2 SO 4 proviene de la fotooxidación del SO 2 liberado de la quema de combustibles fósiles y de operaciones industriales como la fundición.
- El ácido nítrico resulta de manera similar a la fotooxidación de óxidos de nitrógeno. Grandes cantidades de estos óxidos se forman en procesos de combustión a alta temperatura en motores de gasolina y jet, y en los motores de turbina de centrales eléctricas de combustibles fósiles.
- El ácido clorhídrico se forma de forma natural a través de la reacción de aerosoles de sal marina con H 2 SO 4 atmosféricos y HNO 3. Las partículas de sal se forman cuando las olas del océano rompen la superficie y parte del agua se evapora antes de que la pulverización se asiente de nuevo a la superficie. En una escala mucho menor, se cree que la combustión de combustibles fósiles y la incineración de desechos son las principales fuentes de HCl causadas por el hombre.
Deposición húmeda y seca
Existen dos mecanismos básicos por los cuales el material ácido es transportado a través del ambiente. El ácido que se disuelve en las gotas de agua que forman nubes y precipitación, y finalmente se incorpora a la niebla y los copos de nieve, sufre deposición húmeda; esto es normalmente lo que se conoce como “lluvia ácida”. Debido a que está ampliamente disperso, a menudo alto en la atmósfera, puede viajar distancias muy grandes desde la fuente original.
Alrededor del 40% de las sustancias ácidas introducidas en la atmósfera se adsorben sobre la materia particulada, que puede ser hollín, humo, polvo soplado por el viento y partículas de sal formadas naturalmente a partir de la pulverización del mar. Esto se extiende menos ampliamente (típicamente alrededor de 30 km de la fuente), y cae sobre las superficies por "deposición seca”. Una vez que las partículas cargadas de ácido aterrizan sobre las superficies, la lluvia ordinaria, la niebla y el rocío liberan los componentes ácidos, a menudo en forma considerablemente más concentrada que la que ocurre solo a través de la deposición seca.
Efectos en suelos
Debido a que los suelos apoyan el crecimiento de las plantas y de los microorganismos del suelo que son agentes esenciales en el reciclaje de materiales vegetales muertos, la lluvia ácida tiene un efecto indirecto pero profundo sobre la salud del suelo y el crecimiento de las plantas.
↓ Haga clic en la imagen para agrandar
Regiones de suelo mal amortiguado en Estados Unidos
↓ Haga clic en la imagen para agrandar
Regiones de suelo mal amortiguado en Canadá
Los suelos que contienen componentes alcalinos (más comúnmente caliza CaCo 3 y otros carbonatos insolubles) pueden neutralizar el ácido agregado y mitigar sus efectos. Pero los suelos en las regiones de alta montaña tienden a ser delgados e incapaces de proporcionar una capacidad de amortiguación adecuada. Lo mismo ocurre en casi la mitad de Canadá, en la que la roca de granito del Escudo Canadiense se encuentra muy cerca de la superficie; las provincias orientales del país se ven fuertemente impactadas por la lluvia ácida.
- La mayoría de los suelos también contienen arcilla y sustancias húmicas que se unen y retienen iones como Ca 2+, Mg 2+ y K + que son nutrientes esenciales de las plantas. El H + agregado se une aún más fuertemente a estas sustancias, desplazando los iones nutritivos de las capas superiores. El efecto general es lixiviar estos iones a mayores profundidades donde puedan ser inaccesibles para las plantas, o lavarlos en el agua subterránea.
- El componente SO 4 2— de la lluvia ácida convierte algunos cationes nutritivos en sulfatos insolubles, reduciendo su disponibilidad para las plantas.
- Las arcillas, que son aluminosilicatos complejos, se descomponen gradualmente, liberando iones de aluminio que normalmente forman Al (OH) 3 insoluble. La adición de H + disuelve este hidróxido, elevando la concentración de Al (H 2 O) 6 3+ a niveles que pueden ser tóxicos para las plantas.
- Muchos metales pesados tóxicos como Pb, Cd y Cr están presentes en cantidades traza en los suelos pero están amarrados en forma de sales insolubles. La lluvia ácida puede movilizar los iones de estos metales, al igual que ocurre con el aluminio.
Efectos en las plantas
↓ Haga clic en la imagen para agrandar
Hoja dañada por lluvia ácida
↓ Haga clic en la imagen para agrandar
Bosque en Estados Unidos Andirondacks dañados por lluvia ácida
Los efectos sobre los suelos señalados anteriormente afectan a las plantas con mayor fuerza. Sin embargo, el impacto directo de lluvia ácida y niebla en las hojas tiene otros efectos que pueden ser especialmente graves cuando se encuentran presentes contaminantes del aire como el SO 2.
- La deposición ácida sobre hojas y agujas tiende a debilitarlas al erosionar sus recubrimientos cerosos protectores. Esto a menudo resulta en el desarrollo de manchas marrones que interfieren con la fotosíntesis.
- Los bosques de las regiones montañosas suelen estar bañados por nubes y neblinas que pueden ser incluso más ácidas que las precipitaciones normales, exacerbando el problema anterior. Además, las hojas y agujas tienden a acumular el aerosol de niebla en gotitas más grandes. Estos eventualmente caen al suelo del bosque, magnificando los efectos sobre los suelos descritos en el apartado anterior.
- Los cultivos alimentarios tienden a verse menos afectados por la lluvia ácida donde las buenas prácticas agrícolas como la adición de fertilizantes para reemplazar los nutrientes agotados y la adición de piedra caliza para elevar el pH del suelo.
Efectos en lagos y ecosistemas acuáticos
Los lagos están sujetos no solo a la deposición ácida húmeda y seca, sino también por el agua que reciben de los arroyos y escorrentía superficial. Cualquier elemento tóxico liberado por la acción de la lluvia ácida sobre suelos y sedimentos puede así ser transportado a, y concentrado dentro de los lagos y los arroyos que los vacían.
↓ Haga clic en la imagen para agrandar
Regiones de lagos mal amortiguados en América del Norte en 1980
↓ Haga clic en la imagen para agrandar Lago de
Mayo en las Sierras de California - un típico lago alpino
Los lagos en áreas mal amortiguadas como los que se encuentran en las regiones alpinas (oeste de América del Norte, Colorado y gran parte de Suiza) o en el Escudo Canadiense y en los Adirondacs y los Apalaches) son altamente sensibles a la deposición ácida.
Los lagos severamente acidificados (como el que se muestra a la derecha arriba) pueden estar tan desprovistos de vida, incluidas las algas, que el agua parece ser perfectamente clara y de color azul brillante.
↓ Haga clic en la imagen para agrandar
Tolerancias de pH de algunos organismos acuáticos
Los organismos acuáticos generalmente se adaptan a condiciones de pH “ordinarias” de 6-8, pero varían mucho en su tolerancia a pH bajo. A medida que el pH disminuye por debajo de 6, la diversidad de animales acuáticos, plantas y microorganismos disminuye.
- Algunas especies de plantas como los musgos esfagnos y ciertas algas filamentosas que prosperan a pH muy bajo pueden proliferar en lagos acidificados, produciendo gruesos tapetes que sellan el oxígeno y así inhiben la descomposición de la hojarasca en el fondo del lago.
- El ácido depositado sobre la nieve invernal se libera durante el derretimiento primaveral y puede causar caídas rápidas del pH en lagos mal amortiguados que reciben aguas de estas fuentes. Este “choque ácido primaveral” puede afectar seriamente la viabilidad de organismos como peces, anfibios e insectos que ponen sus huevos en el agua que eclosionan en la primavera. Las crías suelen ser incapaces de adaptarse al cambio rápido, y terminan deformadas o muertas.
-
Incluso aquellas especies acuáticas capaces de sobrevivir en aguas de pH bajo pueden verse afectadas indirectamente si su suministro de alimentos es limitado en pH. Por ejemplo, las moscas de mayo y algunos otros insectos, que, que son importantes fuentes de alimento para las ranas, no pueden sobrevivir por debajo de pH 5.5.
↓ Haga clic en la imagen para agrandar

Peces dañados por deposición ácida
- Los peces se ven severamente afectados por el aluminio que se libera de la acción del ácido sobre los sedimentos; provoca que se forme una capa de moco en las branquias, impidiendo la absorción de oxígeno. Esto ha llevado a la extinción de algunas especies de los lagos afectados.
- El pH bajo aumenta la solubilidad de las sales de calcio, dificultando la formación de hueso en embriones en desarrollo de peces y anfibios.
- El pH bajo también puede hacer que los huevos del organismo acuático sean más gruesos y más difíciles de penetrar para los embriones, retrasando así la eclosión. Cuando los embriones continúan creciendo dentro del espacio confinado del óvulo, sus espinas pueden deformarse, interfiriendo con su viabilidad cuando finalmente eclosionan.
Efectos en edificios y estatuas
¡La lluvia ácida no es nueva!
“A menudo se ha observado que las piedras y ladrillos de edificios, especialmente bajo partes salientes, se desmoronan más fácilmente en los grandes pueblos donde se quema carbón... Me llevaron a atribuir este efecto a la acción lenta pero constante de la lluvia ácida”. Robert Angus Smith, 1856
La deposición ácida afecta más fuertemente a los edificios patrimoniales hechos de piedra caliza y materiales similares que contienen carbonato.
El principal proceso químico implica la reacción del ácido sulfúrico con carbonato de calcio:
\[\ce{CO3(s) + H2SO4 → CaSO4(s) + CO2}.\]
El ácido primero erosiona y rompe la superficie de la piedra. A medida que se forma el sulfato de calcio hidratado (yeso), recoge hierro y otros componentes de la piedra y forma una antiestética capa negra. Parte de esto poco a poco se desprenden ampollas, exponiendo aún más suface de piedra. Los cristales de yeso a veces pueden crecer en la piedra, socavando aún más la superficie.
Estructuras muy antiguas como el Taj Mahal, Notre Dame, el Coliseo y la Abadía de Westminster se han visto afectadas.
↓ Haga clic en la imagen para agrandar Edificios y monumentos de
piedra son rápidamente dañados por la lluvia ácida

Los survaces superiores expuestos de la gárgola comienzan a deteriorarse.
Las estatuas y monumentos, incluidos los hechos de mármol, también son susceptibles de erosión y daños por deposición ácida.
Los edificios modernos se ven menos afectados, aunque la lluvia ácida puede erosionar algunas superficies pintadas.
El sistema de Carbonato Geoquímico
El sistema de carbonato, que consiste como lo hace de un gas soluble CO 2, iones solubles HCO 3 — y CO 3 2—, y sales carbonatadas escasamente solubles, abarca los cuatro reinos de la naturaleza: la atmósfera, la hidrosfera (principalmente los océanos), la litosfera y el biosfera. Y debido a los equilibrios ácido-base que rigen las transformaciones entre estas especies carbonatadas, el carbono se transporta fácilmente entre estos reservorios geoquímicos. Este capítulo presenta una visión general de la geoquímica del carbono.
Distribución del carbono en la Tierra
El carbono es el cuarto elemento más abundante del universo. Dentro de la corteza terrestre ocupa el lugar 15, en su mayoría en forma de carbonatos en calizas y dolomitas. Los cerógenos, que son carbono fosilizado derivado de plantas principalmente en forma de esquisto bituminoso, constituyen otro importante depósito de carbono terrestre.
| Fuente | relativo a la atmósfera | |
|---|---|---|
|
roca carbonatada
|
roca carbonatada
|
28,500
|
|
carbono fósil
|
572
|
10,600
|
|
tierra - carbono orgánico
|
0.065
|
1.22
|
|
océano
|
3.2
|
61.8
|
|
CO atmosférico 2
|
0.0535
|
1.0
|
El ciclo geoquímico del carbono
El sistema de carbonato abarca prácticamente todos los compartimentos ambientales: la atmósfera, la hidrosfera, la biosfera y las partes principales de la litosfera. Los procesos complementarios de fotosíntesis y respiración impulsan un ciclo global en el que el carbono pasa lentamente entre la atmósfera y la litosfera, y más rápidamente entre la atmósfera y los océanos. Así, el “ciclo del carbono” se puede dividir en partes “rápidas” y “lentas”, operando aproximadamente en escalas de tiempo anuales y geológicas.
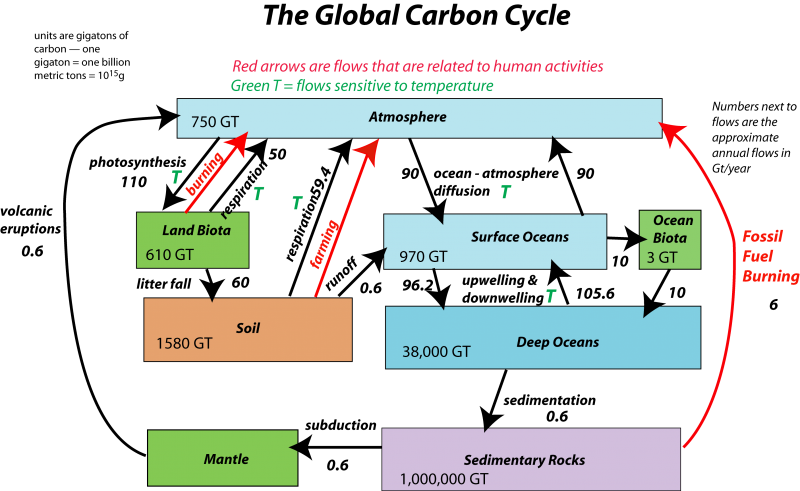
Figura (\ PageIndex {2}\): Imagen de David Bise, Pennsylvania State University; vea aquí para una discusión completa de este diagrama.
Otra excelente representación del ciclo del carbono, por el Departamento de Energía de Estados Unidos. (Ver descripción):
Ciclo de Carbono
Dióxido de carbono en la atmósfera
El CO 2 probablemente siempre ha estado presente en la atmósfera en las cantidades absolutas relativamente pequeñas ahora observadas. Calizas precámbricas, posiblemente formadas por reacciones con silicatos formadores de rocas, p.
\[\ce{CaSiO_3 + CO_2 → CaCO_3 + SiO_2} \label{4-1}\]
probablemente han tenido una influencia moderadora en la abundancia de CO 2 a lo largo del tiempo geológico.
El porcentaje en volumen de CO 2 en el aire seco es de 0.032%, lo que lleva a una presión parcial de 3 × 10 —4 (10 3.5) atm. En una habitación abarrotada y mal ventilada, el P CO2 puede ser tan alto como 100 × 10 —4 atm. Aproximadamente 54 × 10 14 moles por año de CO 2 se toman de la atmósfera por fotosíntesis, divididos aproximadamente por igual entre tierra y mar. De esto, todos excepto 0.05% son devueltos por respiración (en su mayoría por microorganismos); el resto se filtra a la parte lenta y sedimentaria del ciclo geoquímico donde puede permanecer de miles a millones de años. Las tendencias en el crecimiento del CO 2 atmosférico durante los últimos cinco años se pueden ver en esta página de la NOAA de Estados Unidos.
Desde el advenimiento de la industrialización a gran escala alrededor de 1860, la cantidad de CO 2 en la atmósfera ha ido en aumento. La mayor parte de esto se ha debido a la combustión de combustibles fósiles; en 1966, se liberaron a la atmósfera alrededor de 3.6 × 10 15 g de C; esto es aproximadamente 12 veces mayor que la remoción natural estimada de carbono en sedimentos. Se cree que la destrucción a gran escala de los bosques tropicales, que se ha acelerado mucho en los últimos años, exacerba este efecto al eliminar un sumidero temporal de CO 2.
Alrededor del 30-50% del CO 2 liberado a la atmósfera por combustión permanece allí; el resto ingresa a la hidrosfera y biosfera. Los océanos tienen una gran capacidad de absorción de CO 2 en virtud de su transformación en bicarbonato y carbonato en un medio acuoso ligeramente alcalino, y contienen aproximadamente 60 veces más carbono inorgánico que en la atmósfera. Sin embargo, la transferencia efectiva se lleva a cabo solo a la capa más alta
(100 m) mezclada con viento, que contiene solo alrededor de una atmósfera equivalente de CO 2; el tiempo de mezcla en las partes más profundas del océano es del orden de 1000 años. Por esta razón, sólo alrededor del diez por ciento del CO 2 agregado es absorbida por los océanos.
La mayor parte del carbono en los océanos está en forma de bicarbonato, como se esperaría del pH que oscila entre 7.8 y 8.2. Además del CO 2 atmosférico, hay una entrada de carbonato al océano desde los arroyos. Esto es principalmente en forma de HCO 3, que deriva de la meteorización de rocas y sedimentos carbonatados terrestres, y la reacción ácido-base
\[H_2CO_3 + CO_3^{2–} → 2 HCO_3^– \label{4-2}\]
que puede considerarse como la fuente de bicarbonato en el agua de mar. En este sentido, el océano puede considerarse el sitio de una gigantesca titulación ácido-base en la que los ácidos atmosféricos (principalmente CO 2 pero también SO 2, HCl y otros ácidos de origen volcánico) reaccionan con bases que se originan en rocas y se introducen a través de arroyos portadores de carbonato o en polvo soplado por el viento.
Carbono en la hidrosfera
Disolución de CO 2 en agua
El dióxido de carbono es ligeramente soluble en agua:
| °C |
0
|
4
|
10
|
20
|
|---|---|---|---|---|
| mol L —1 |
0.077
|
0.066
|
0.054
|
0.039
|
La ley de Henry es seguida hasta una presión de CO 2 de aproximadamente 5 atm:
\[[\ce{CO2 (aq)}] = 0.032 P_{\ce{CO_2}} \label{4-3}\]
“Dióxido de carbono disuelto” consiste principalmente en el óxido hidratado CO2 (ac) junto con una pequeña proporción de ácido carbónico:
\[[\ce{CO2 (aq)}] = 650 [\ce{H2CO3}] \label{4-4}\]
La constante de disociación ácida\(K_{a1}\) que comúnmente se cita para “H 2 CO 3" es realmente una constante de equilibrio compuesta que incluye el equilibrio anterior. Esto significa que el H 2 CO 3 “puro” (que no se puede aislar) es un ácido considerablemente más fuerte de lo que suele apreciarse.
Distribución de especies carbonatadas en soluciones acuosas
El agua expuesta a la atmósfera con P CO2 = 10 3.5 atm absorberá dióxido de carbono, el cual se distribuirá entre las tres especies carbonatadas CO 2, HCO 3 —y CO 3 2— en proporciones que dependen de K 1 y K 2 y sobre el pH. El “carbono disuelto total” viene dado por el balance de masas
\[C_t = [H_2CO_3] + [HCO_3^–] + [CO_3^{2–}] \label{4-5}\]
La distribución de estas especies en función del pH se puede ver mejor mediante la construcción de un diagrama log C-pH para C t = 10 —5 M.
Esta parcela de Sillén se dibuja para dos concentraciones diferentes del sistema de carbonatos. La inferior, en líneas más pesadas, es para una solución de 10 —5 M, correspondiente aproximadamente al CO 2 atmosférico en equilibrio con agua pura. La parcela superior, para una solución de 10 —3 M, es representativa de muchas aguas naturales como lagos y arroyos donde el agua está en contacto con sedimentos.
Es importante señalar que este diagrama se aplica únicamente a un sistema en el que C t es constante. En una solución que esté abierta a la atmósfera, este no será el caso a valores de pH altos donde la concentración de CO 2 sea apreciable. Bajo estas condiciones este ion reaccionará con H 2 CO 3 y la solución absorberá CO 2 de la atmósfera, resultando finalmente en la formación de un precipitado de carbonato sólido.
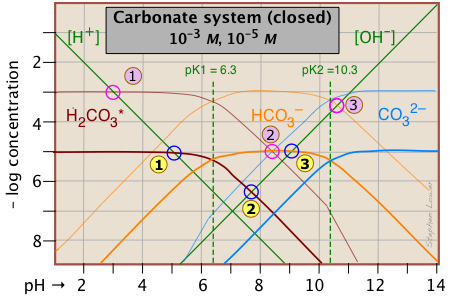
La menor de las dos parcelas anteriores se puede utilizar para predecir el pH de 10^ {5} M soluciones de dióxido de carbono, bicarbonato de sodio y carbonato de sodio en agua pura. Los valores de pH se estiman utilizando las condiciones de balance de masa y carga para cada solución como se indica a continuación.
El razonamiento que condujo a estos cálculos se explica en la discusión del sistema de carbonato de 10 —3 M en un capítulo anterior.
- Solución de CO 2 o H 2 CO 3
- [H +] = [OH —] + [HCO 3 —] + 2 [CO 3 2—] (4-6)
- que, dado que la solución será ácida, puede simplificarse a
- [H +] = [HCO 3 —] (punto
) (4-7)
- Solución de NaHCO 3
- [H +] + [H 2 CO 3] = [CO 3 2—] + [OH] (4-8)
- o
- [H +] = [HCO 3 —] (punto
) (4-9)
- Solución de Na 2 CO 3
- [H +] + 2 [H 2 CO 3] + [CO 3 2—] = [OH —] (4-10)
- o
- [HCO 3 —] = [OH —] (punto
) (4-11)
Carbono en los océanos
Las aguas naturales adquieren carbono de los sedimentos con los que están en contacto, y por supuesto también de la atmósfera. El pH es un factor importante aquí; el CO 2 y los carbonatos sólidos son más solubles a pH alto, y el pH también controla la distribución de las especies de carbono, como se ve en la parcela justo arriba.
| lluvia | agua de río/lago | agua de mar | |
|---|---|---|---|
| ppm de carbono |
1.2
|
35
|
140
|
| pH (no contaminado) |
5.6
|
6.5 - 8.5
|
7.5 - 8.4
|
Al pH ligeramente alcalino de la mayoría de los cuerpos de agua (de los cuales los océanos constituyen 97% de las aguas superficiales de la tierra), el bicarbonato es la principal especie de carbono disuelto. La cantidad de carbono orgánico es bastante pequeña.
| CO 2 (aq) | HCO 3 — | CO 3 2— | muertos org. | vida org. |
|---|---|---|---|---|
|
0.18
|
2.6
|
0.33
|
0.23
|
0.05
|


