15.1: La dispersión de energía impulsa el cambio espontáneo
- Page ID
- 71053
Se espera que sea capaz de definir y explicar la significación de los términos identificados en negrita.
- S cambio pontáneo es aquel que, una vez iniciado, procede por sí solo hasta alcanzar algún estado de equilibrio (mecánico, térmico, químico, etc.).
- Todos los procesos naturales (los que ocurren en el mundo) implican en última instancia un cambio espontáneo.
- La energía hermal T es la energía cinética asociada con los movimientos aleatorios de átomos y moléculas. Estos estados de movimiento se cuantifican en estados de energía que se pueden realizar en grandes cantidades de formas diferentes que llamamos microestados. no serán hermalmente accesibles y probablemente estarán pobladas.
- El cambio espontáneo es impulsado por la tendencia de la energía térmica a extenderse a tantos microestados del sistema y alrededores como sean térmicamente accesibles.
Deja caer una bolsita de té en una olla con agua caliente, y verás que el té se difunde en el agua hasta que se distribuya uniformemente por todo el agua. Lo que nunca verás es lo contrario de este proceso, en el que el té sería succionado y reabsorbido por la bolsita de té. La elaboración del té, como todos los cambios que tienen lugar en el mundo, posee una dirección “natural”.
¿Qué es un proceso espontáneo?
Los procesos que proceden en una dirección definida cuando se dejan a sí mismos y en ausencia de cualquier intento de conducirlos a la inversa, se conocen como proceso natural o cambios espontáneos. En muchos casos nuestras experiencias cotidianas nos enseñan la dirección en la que puede ocurrir el cambio espontáneo, y cualquier cosa que vaya en contra de estas expectativas es inmediatamente percibida como extraña. En otros casos, incluido el de la mayoría de los cambios químicos, a menudo no tenemos pautas obvias, y debemos aprender a aplicar las leyes de la termodinámica que en última instancia gobiernan todo cambio espontáneo.
Para responder a la pregunta anterior, comencemos pensando en los resultados de los siguientes cuatro experimentos, cada uno de los cuales ilustra un proceso natural que transcurre espontáneamente sólo en una sola dirección.
Se lanza al aire una pila de cien monedas. Después de que hayan venido a descansar al piso, se anotan los números que aterrizan “cabeza arriba” y “cola arriba”.
Cambio neto: monedas ordenadas → monedas aleatorias (números aproximadamente iguales de cabezas y colas.)
Energética: no hay cambio neto relevante en la energía
Por qué no va a la inversa: Las estadísticas simples muestran que la probabilidad de que las monedas aterricen en un arreglo particular del enorme número que son posibles es esfumantemente pequeña.
Dos bloques idénticos de cobre, uno a 200°C y el otro a 100°C, se ponen en contacto en un ambiente térmicamente aislado. Eventualmente las temperaturas de ambos bloques alcanzan los 150°C.
Cambio neto: bloque1 (200°) + bloque2 (100°) → bloques combinados (150°)
Energética: El calor (energía cinética molecular aleatoria) fluye del bloque más cálido al más frío hasta que sus temperaturas son idénticas.
Por qué no va a la inversa: La dispersión de la energía cinética entre los átomos de cobre es un proceso aleatorio; las posibilidades de que tal proceso conduzca a una distribución no uniforme de la energía son incluso menores que en el caso de las 100 monedas debido a la gran cantidad de mayor número (alrededor de 10 22) de partículas involucradas.
Un libro o algún otro objeto sólido se sostiene sobre una mesa, y luego se le permite caer.
Cambio neto: libro en aire libro sobre mesa; energía potencial
organizada energía cinética energía
térmica.
Energética: En el instante justo antes del final de su caída, la energía potencial que el objeto adquirió cuando fue levantado existirá enteramente como energía cinética mv 2 /2 en la que m es la masa del objeto y v es su velocidad. Cada átomo del que esté compuesto el objeto, por supuesto, poseerá una fracción proporcional de esta energía, nuevamente con su componente principal de velocidad apuntando hacia abajo. Sobre esto, sin embargo, se superpondrán desplazamientos térmicos diminutos que varían aleatoriamente en magnitud y dirección de un instante a otro. La suma total de estos constituye la energía térmica contenida en el objeto.
Cuando el objeto golpea el tablero de la mesa, su movimiento cesa y decimos que su energía cinética es cero. Se supone que la energía debe ser conservada, entonces, ¿a dónde desapareció? El choque de impacto ha resultado en su dispersión en movimientos térmicos muy aumentados de los átomos, tanto del objeto mismo como del área de la superficie de la mesa donde ocurrió el impacto. En otras palabras, la energía cinética del movimiento organizado que tenía el objeto justo antes de que se detuviera su movimiento se ha transformado en energía cinética de movimiento aleatorio o desorganizado (energía térmica) que se propaga rápidamente lejos del punto de impacto.
Por qué no va a la inversa: Una vez que la energía cinética del libro se ha dispersado entre las moléculas del libro y el tablero de la mesa, la probabilidad de que estos movimientos aleatorios reaparezcan en la superficie donde los dos objetos están en contacto y luego actuar en concierto para impulsar el objeto de nuevo al aire) es insignificante.
Se permite que un mol de gas, inicialmente a 300 K y 2 atm de presión, se expanda para duplicar su volumen, manteniendo la temperatura constante.
Cambio neto: Incremento en volumen de gas.
Energética: No hay cambios en la energía si el gas se comporta de manera ideal.
Por qué no va a la inversa: Estadísticas simples: la probabilidad de que N objetos que se mueven aleatoriamente (vuela en una botella, por ejemplo,) en cualquier momento estén todos ubicados en la mitad del contenedor es (1/2) N. Para valores químicamente significativos de N (10 20, digamos) esta probabilidad es indistinguible de cero.
Todos los cambios descritos anteriormente tienen lugar espontáneamente, lo que significa que
- Una vez que se les permita comenzar, procederán a la meta sin ninguna intervención externa.
- Sería inconcebible que alguno de estos cambios pudiera ocurrir en sentido inverso (es decir, deshacerse) sin cambiar las condiciones o perturbar activamente el sistema de alguna manera.
¿Qué determina la dirección en la que ocurrirá el cambio espontáneo? Claramente no es una caída en la energía, ya que en la mayoría de los casos citados anteriormente la energía del sistema no cambió. Incluso en el caso del libro descendente, en el que cae la energía potencial del sistema (el libro), la energía se conserva en general; si no hay pérdida neta de energía cuando estos procesos operan en la dirección hacia adelante o natural, no requeriría ningún gasto de energía para que operen a la inversa. En otras palabras, contrariamente a lo que parece creer demasiada gente, la Primera Ley de la Termodinámica no puede predecir la dirección de un proceso natural.
La dirección de un proceso espontáneo no se rige por el cambio energético y así la Primera Ley de la Termodinámica no puede predecir la dirección de un proceso natural
Dirección a través del trastorno
En nuestro examen de los procesos descritos anteriormente, vimos que aunque la energía total del sistema y del entorno (y por lo tanto, del mundo) no ha cambiado, hay algo en el mundo que ha cambiado, y este es su grado de desorden.
Después de que las monedas han sido lanzadas o barajadas cartas, el estado final es invariablemente uno de mayor desorden. De igual manera, las moléculas de un gas pueden ocupar un mayor número de posiciones posibles en el espacio si el volumen es mayor, por lo que la expansión de un gas va acompañada de un aumento en la aleatoriedad
¿Cómo podemos expresar el desorden cuantitativamente? Del ejemplo de las monedas, probablemente puedas ver que las estadísticas simples juegan un papel: la probabilidad de obtener tres cabezas y siete colas después de lanzar diez monedas es solo la relación entre el número de formas en que diez monedas diferentes se pueden organizar de esta manera, al número de todos los arreglos posibles de diez monedas.

Utilizando el lenguaje de la estadística molecular, decimos que una colección de monedas en la que una fracción dada de sus miembros son heads-up constituye un estado macroscópico del sistema. Como no nos importa qué monedas son heads-up, hay claramente numerosas configuraciones de las monedas individuales que pueden resultar en este “macroestado”. Cada una de estas configuraciones especifica un estado microscópico del sistema. Cuanto mayor sea el número de microestados que corresponden a un macroestado dado, mayor es la probabilidad de ese macroestado. Para ver lo que esto significa, considere los posibles resultados de un lanzamiento de cuatro monedas (Tabla\(\PageIndex{1}\)):
| macroestado | formas | probabilidad | microestados |
|---|---|---|---|
| 0 cabezas | 1 | 1/16 | TTTT |
| 1 cabeza | 4 | 4/16 = 1/4 | HTTT THTT TTHT TTTH |
| 2 cabezas | 6 | 6/16 = 3/8 | HHTT HTHT HTTH THHT THHT TTHH THTH |
| 3 cabezas | 4 | 4/16 = 1/4 | HHHT HTHH HHTH THHH |
| 4 cabezas | 1 | 1/16 | HHHH |
Un lanzamiento de cuatro monedas arrojará uno de los cinco resultados (macroestados) enumerados en la columna más a la izquierda de la tabla. La segunda columna da el número de “vías” —es decir, el número de configuraciones cabeza/cola del conjunto de monedas (el número de microestados )— que pueden dar como resultado el macroestado. La probabilidad de que un lanzamiento resulte en un macroestado particular es proporcional al número de microestados correspondientes al macroestado, y es igual a este número, dividido por el número total de microestados posibles (en este ejemplo, 2 4 =16). Una suposición importante aquí es que todos los microestados son igualmente probables; es decir, el lanzamiento es uno “justo” en el que los muchos factores que determinan la trayectoria de cada moneda operan de una manera completamente aleatoria.
Cuanto mayor sea el número de microestados que corresponden a un macroestado dado, mayor es la probabilidad de ese macroestado.
El trastorno es más probable que el orden porque hay muchas más formas de lograrlo. Así, las monedas y las cartas tienden a asumir configuraciones aleatorias cuando se lanzan o barajan, y los calcetines y libros tienden a dispersarse más por la habitación de un adolescente durante el transcurso de la vida diaria. Pero hay algunas diferencias importantes entre estos sistemas mecánicos, o macro a gran escala, y las colecciones de partículas submicroscópicas que constituyen el material de la química, y a las que aquí nos referiremos genéricamente como moléculas. Las moléculas, a diferencia de los macroobjetos, son capaces de aceptar, almacenar y renunciar a la energía en pequeñas cantidades (cuantos), y actúan como portadores y esparcidores de energía térmica altamente eficientes a medida que se mueven. Así, en los sistemas químicos,
- Estamos tratando con un gran número de partículas. Esto es importante porque las predicciones estadísticas son siempre más precisas para muestras más grandes. Así, aunque para los cuatro lanzamientos hay una buena probabilidad (62%) de que la relación H/T caiga fuera del rango de 0.45 - 0.55, esta probabilidad se vuelve casi nula para 1000 lanzamientos. Para expresar esto de una manera diferente, las posibilidades de que 1000 moléculas de gas que se muevan aleatoriamente en un recipiente se distribuyan en cualquier instante de una manera suficientemente no uniforme para producir una diferencia de presión detectable entre las dos mitades de un recipiente serán extremadamente pequeñas. Si aumentamos el número de moléculas a un número químicamente significativo (alrededor de 10 20, digamos), entonces la misma probabilidad se vuelve indistinguible de cero.
- Una vez que comienza el cambio, procede espontáneamente. Es decir, no se necesita ningún agente externo (un lanzador, barajador o adolescente) para mantener el proceso en marcha. Los gases se expandirán espontáneamente si se les permite, y las reacciones, una iniciada, procederán hacia el equilibrio.
- La energía térmica se intercambia continuamente entre las partículas del sistema, y entre el sistema y los alrededores. Las colisiones entre moléculas resultan en intercambios de impulso (y por lo tanto de energía cinética) entre las partículas del sistema, y (a través de colisiones con las paredes de un contenedor, por ejemplo) con el entorno.
- La energía térmica se propaga rápida y aleatoriamente a través de los diversos microestados energéticamente accesibles del sistema. La dirección del cambio espontáneo es aquella que da como resultado la máxima difusión y distribución posible de la energía térmica.
La importancia de estos dos últimos puntos es mucho mayor de lo que se podría pensar en un principio, pero para apreciarlo plenamente, debe recordar las diversas formas en que la energía térmica se almacena en las moléculas, de ahí la siguiente breve revisión.
La difusión de la energía
La energía térmica es la porción de energía de una molécula que es proporcional a su temperatura y, por lo tanto, se relaciona con el movimiento a escala molecular. ¿Qué tipo de movimientos moleculares son posibles? Para las moléculas monatómicas, solo hay una: el movimiento real de un lugar a otro, lo que llamamos traducción. Dado que hay tres direcciones en el espacio, todas las moléculas poseen tres modos de movimiento traslacional.
Para las moléculas poliatómicas, son posibles dos tipos adicionales de movimientos. Una de ellas es la rotación; una molécula lineal como el CO 2 en la que todos los átomos están dispuestos a lo largo del eje x puede rotar a lo largo de los ejes y y z, mientras que las moléculas que tienen menos simetría pueden rotar alrededor de los tres ejes. Así, las moléculas lineales poseen dos modos de movimiento rotacional, mientras que las no lineales tienen tres modos rotacionales.
Finalmente, las moléculas que constan de dos o más átomos pueden sufrir vibraciones internas. Para las moléculas que se mueven libremente en un gas, el número de modos o patrones vibracionales depende tanto del número de átomos como de la forma de la molécula, y aumenta rápidamente a medida que la molécula se vuelve más complicada.
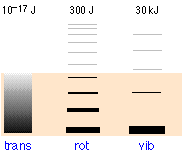
Las poblaciones relativas de los estados de energía traslacional, rotacional y vibracional de una molécula diatómica típica se representan por el grosor de las líneas en este esquema (¡no a escala!) diagrama. El sombreado coloreado indica la energía térmica total disponible a una temperatura dada. Los números en la parte superior muestran separaciones de orden de magnitud entre niveles adyacentes. Es fácilmente evidente que prácticamente toda la energía térmica reside en estados de traslación.
Observe el espaciamiento muy diferente de los tres tipos de niveles de energía. Esto es extremadamente importante porque determina el número de cuantos de energía que una molécula puede aceptar y, como muestra la siguiente ilustración, el número de diferentes formas en que esta energía puede distribuirse entre las moléculas.

Estados energéticos accesibles. Cuanto más estrechamente estén los estados de energía cuantificados de una molécula, mayor será el número de formas en que una cantidad dada de energía térmica puede ser compartida entre una colección de estas moléculas.
El espaciamiento de los estados de energía molecular se acerca a medida que aumenta la masa y el número de enlaces en la molécula, por lo que generalmente podemos decir que cuanto más compleja es la molécula, mayor es la densidad de sus estados energéticos. Esta es una característica del modelo de partículas en una caja, que predice que la separación de los estados energéticos de un gas confinado dentro de una caja depende del cuadrado inverso de la longitud de la caja (y también de la inversa de la masa de partícula).
Estados cuánticos, microestados y dispersión de energía
A nivel atómico y molecular, se cuantifica toda la energía; cada partícula posee estados discretos de energía cinética y es capaz de aceptar energía térmica solo en paquetes cuyos valores corresponden a las energías de uno o más de estos estados. Las moléculas poliatómicas pueden almacenar energía en movimientos rotacionales y vibratorios, y todas las moléculas (incluso las monatómicas) poseerán energía cinética traslacional (energía térmica) a todas las temperaturas por encima del cero absoluto. La diferencia de energía entre los estados de traducción adyacentes es tan pequeña (aproximadamente 10 —30 J) que la energía cinética traslacional puede considerarse continua (no cuantificada) para la mayoría de los propósitos prácticos.
El número de formas en que la energía térmica puede distribuirse entre los estados permitidos dentro de una colección de moléculas se calcula fácilmente a partir de estadísticas simples, pero aquí nos limitaremos a un ejemplo. Supongamos que tenemos un sistema que consta de tres moléculas y tres cuantos de energía para compartir entre ellas. Podemos darle toda la energía cinética a cualquier molécula, dejando a las otras sin ninguna, podemos dar dos unidades a una molécula y una unidad a otra, o podemos compartir la energía por igual y dar una unidad a cada molécula. Dicho todo, hay diez formas posibles de distribuir tres unidades de energía entre tres moléculas idénticas como se muestra aquí:

Cada una de estas diez posibilidades representa un microestado distinto que describirá el sistema en cualquier instante en el tiempo. Aquellos microestados que poseen distribuciones idénticas de energía entre los niveles cuánticos accesibles (y difieren solo en qué moléculas particulares ocupan los niveles) se conocen como configuraciones. Debido a que todos los microestados son igualmente probables, la probabilidad de cualquier configuración es proporcional al número de microestados que pueden producirla. Así, en el sistema mostrado anteriormente, la configuración etiquetada ii se observará 60% del tiempo, mientras que iii ocurrirá solo 10% del tiempo.
A medida que aumenta el número de moléculas y el número de cuantos, el número de microestados accesibles crece explosivamente; si 1000 cuanta de energía son compartidos por 1000 moléculas, el número de microestados disponibles será de alrededor de 10 600, un número que supera en gran medida el número de átomos en el observable universo! El número de configuraciones posibles (como se definió anteriormente) también aumenta, pero de tal manera que se reduce en gran medida la probabilidad de todas las configuraciones excepto las más probables. Así, para una muestra de un gas lo suficientemente grande como para ser observable en condiciones normales, solo se necesita considerar una única configuración (distribución de energía entre los estados cuánticos); incluso la segunda configuración más probable puede ser descuidada.
La conclusión: cualquier colección de moléculas lo suficientemente grandes en número como para tener importancia química tendrá su energía terrmal distribuida sobre un número inimaginablemente grande de microestados. El número de microestados aumenta exponencialmente a medida que más estados de energía (“configuraciones” como se definió anteriormente) se vuelven accesibles debido a
- Adición de cuantos de energía (temperatura más alta),
- Incremento en el número de moléculas (resultante de la disociación, por ejemplo).
- el volumen del sistema aumenta (lo que disminuye el espaciamiento entre los estados energéticos, permitiendo que más de ellos sean poblados a una temperatura dada.)
Al aumentar la temperatura se incrementa el número de microestados en un estado y de ahí la entropía del estado.
La difusión de energía cambia el mundo
La energía se conserva; si levantas un libro de la mesa, y lo dejas caer, la cantidad total de energía en el mundo permanece sin cambios. Todo lo que has hecho es transferirlo de la forma en que estaba almacenada dentro de la glucosa en tu cuerpo a tus músculos, y luego al libro (es decir, trabajaste en el libro moviéndolo hacia arriba contra el campo gravitacional de la tierra). Después de que el libro ha caído, esta misma cantidad de energía existe que la energía térmica (calor) en el libro y la mesa.
Lo que ha cambiado, sin embargo, es la disponibilidad de esta energía. Una vez que la energía se ha extendido a la enorme cantidad de microestados térmicos en los objetos calentados, la probabilidad de que se desdisperse espontáneamente (es decir, por casualidad) es esencialmente cero. Así, aunque la energía sigue “ahí”, está para siempre más allá de la utilización o recuperación.
La profundidad de esta conclusión fue reconocida alrededor de 1900, cuando fue descrita por primera vez como la “muerte por calor” del mundo. Esto se refiere al hecho de que cada proceso espontáneo (esencialmente cada cambio que ocurre) va acompañado de la “dilución” de la energía. La implicación obvia es que toda la energía cinética a nivel molecular se esparcirá por completo, y nada más cambiará jamás. ¡No es un pensamiento feliz!
Gases Expanden espontáneamente y nunca se contraen
Todo el mundo sabe que un gas, si se deja solo, tenderá a expandirse para llenar el volumen dentro del cual está confinado completa y uniformemente. ¿Qué “impulsa” esta expansión? En el nivel más simple es claro que con más espacio disponible, los movimientos aleatorios de las moléculas individuales inevitablemente las dispersarán por todo el espacio. Pero como mencionamos anteriormente, los estados energéticos permitidos que las moléculas pueden ocupar están más espaciados en un volumen mayor que en uno más pequeño. Cuanto mayor sea el volumen disponible para el gas, mayor será el número de estados energéticos (y por lo tanto microestados) que puede ocupar su energía térmica. Dado que todos estos microestados dentro del rango de energías térmicamente accesibles son igualmente probables, la expansión del gas puede verse como consecuencia de la tendencia de la energía a propagarse y compartirse lo más ampliamente posible. Una vez que esto ha sucedido, la probabilidad de que este reparto de energía se revierta (es decir, que el gas se contraiga espontáneamente) es tan mínima como para ser impensable.
De hecho, lo mismo puede decirse incluso de otras distribuciones altamente probables, como tener 49.999% de las moléculas en la mitad izquierda del contenedor y 50.001% en la mitad derecha. Aunque el número de posibles configuraciones que producirían esta distribución de moléculas es inconcebiblemente grande, es esencialmente insignificante en comparación con el número que correspondería a una distribución exacta del 50 por ciento.
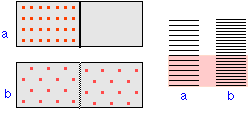
La ilustración representa los estados de energía térmica permitidos de un gas ideal. Cuanto mayor es el volumen en el que está confinado el gas, más estrechamente espaciados están estos estados, resultando en un enorme aumento en el número de microestados en los que puede residir la energía térmica disponible; esto puede considerarse el origen de la “fuerza impulsora” termodinámica para la expansión espontánea de un gas.
El calor fluye espontáneamente de Caliente a Frío
Así como los gases cambian espontáneamente sus volúmenes de “más pequeños a grandes”, el flujo de calor de un cuerpo más cálido a un enfriador siempre opera en la dirección de “más caliente a más frío” porque esto permite que la energía térmica ocupe un mayor número de estados energéticos a medida que se ponen a disposición otros nuevos al traer el cuerpo más frío en contacto con el más cálido; en efecto, la energía térmica se vuelve más “diluida”.

Cuando dos cuerpos a diferentes temperaturas se colocan en contacto térmico, la energía térmica fluye desde el más cálido hacia el más frío hasta que alcanzan la misma temperatura.
- Representación esquemática de los estados de energía térmica en dos cuerpos idénticos separados a diferentes temperaturas (indicado por sombreado).
- Cuando los cuerpos se ponen en contacto térmico, la energía térmica fluye desde los niveles ocupados más altos en el objeto más cálido hacia los niveles desocupados del uno más frío hasta que se ocupan números iguales.
Como cabría esperar, el aumento en la cantidad de energía que se esparce y comparte es proporcional a la cantidad de calor transferido q, pero hay otro factor involucrado, y esa es la temperatura a la que se produce la transferencia. Cuando una cantidad de calor q pasa a un sistema a temperatura T, el grado de dilución de la energía térmica viene dado por q /T
Para entender por qué tenemos que dividir por la temperatura, consideremos el efecto de valores muy grandes y muy pequeños de T en el denominador. Si el cuerpo que recibe el calor está inicialmente a una temperatura muy baja, relativamente pocos estados de energía térmica están ocupados, por lo que la cantidad de energía que se propaga puede ser muy grande. Por el contrario, si la temperatura es inicialmente grande, el número de nuevos estados de energía térmica que se ocupen será despreciable en comparación con el número ya activo.
Difusión y distribución de energía en reacciones químicas
Cuando se produce una reacción química, se involucran dos tipos de cambios relacionados con la energía térmica:
- Las formas en que se puede almacenar la energía térmica dentro de los reactivos generalmente serán diferentes de las de los productos. Por ejemplo, en la reacción H 2 → 2 H, el reactivo dihidrógeno posee estados de energía vibracional y rotacional, mientras que el hidrógeno atómico en el producto solo tiene estados de traslación, pero el número total de estados de traslación en dos moles de H es dos veces mayor que en un mol de H 2 . Debido a su espaciado extremadamente cercano, los estados de traslación son los únicos que realmente cuentan a temperaturas ordinarias, por lo que podemos decir que la energía térmica puede llegar a diluirse dos veces (“esparcirse”) en el producto que en el reactivo. Si este fuera el único factor a considerar, entonces la disociación del dihidrógeno siempre sería espontánea y H 2 no existiría. deben ser sacados de los alrededores para romper el vínculo H-H. Es decir, el estado fundamental (la energía a la que comienza el colector de estados energéticos) es mayor en H, como lo indica el desplazamiento vertical de la mitad derecha en cada uno de los cuatro paneles inferiores.
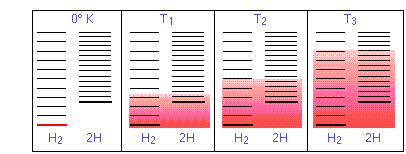
Niveles de energía en H 2 y 2 H. El número de estados de energía térmicamente accesibles (indicados por el sombreado en el diagrama a continuación) aumenta con la temperatura, pero debido a que 2 moles de H poseen el doble de estados de traslación que un mol de H 2, la disociación se vuelve cada vez más favorecidos a temperaturas más altas a medida que más de estos estados H se vuelven térmicamente accesibles.
Este argumento puede generalizarse a todas las moléculas, ilustrando un principio importante:
Todas las moléculas absorben espontáneamente el calor y se disocian a altas temperaturas.
La capacidad de la energía para propagarse en las moléculas del producto está limitada por la disponibilidad de energía térmica suficiente para producir estas moléculas. Aquí es donde entra la temperatura. A cero absoluto la situación es muy simple; no hay energía térmica disponible para provocar la disociación, por lo que el único componente presente será el dihidrógeno.
- A medida que aumenta la temperatura, aumenta el número de estados energéticos poblados, como lo indica el sombreado en el diagrama. A temperatura T 1, el número de estados poblados de H 2 es mayor que el de 2H, por lo que algunos de estos últimos estarán presentes en la mezcla de equilibrio, pero sólo como componente minoritario.
- A alguna temperatura T 2 los números de estados poblados en los dos componentes del sistema de reacción serán idénticos, por lo que la mezcla de equilibrio contendrá H 2 y “2H” en cantidades iguales; es decir, la relación molar de H 2/H será 1:2.
- A medida que la temperatura sube a T 3 y superiores, vemos que el número de estados energéticos que son térmicamente accesibles en el producto comienza a superar el del reactivo.
El resultado es exactamente lo que predice el Principio de Le Chatelier: el estado de equilibrio para una reacción endotérmica se desplaza hacia la derecha a temperaturas más altas. Todo esto está muy bien para ayudarlo a comprender la conexión directa entre la propagación de energía cuando ocurre una reacción química, pero es de poca ayuda para lograr nuestro objetivo de predecir la dirección y el alcance del cambio químico. Para ello, necesitamos incorporar el concepto de difusión de la energía a la termodinámica.


