2.2: Propiedades Macroscópicas y Modelos Microscópicos
- Page ID
- 74865
Como ejemplo sencillo de cómo se pueden explicar las propiedades macroscópicas de una sustancia a nivel microscópico, considere el mercurio líquido. Macroscópicamente, el mercurio a temperaturas normales es un líquido plateado que se puede verter como el agua, algo inusual para un metal. El mercurio es también el líquido más pesado conocido. Su densidad es de 13.6 g cm —3, en comparación con solo 1.0 g cm —3 para el agua. Cuando se enfría por debajo de —38.9°C, el mercurio se solidifica y se comporta de manera muy similar a los metales sólidos más familiares como el cobre y el hierro. El mercurio congelado alrededor del extremo de un palo de madera se puede utilizar para clavar clavos, siempre y cuando se mantenga suficientemente frío. El mercurio sólido tiene una densidad de 14.1 g cm —3 ligeramente mayor que la del líquido.
Cuando el mercurio se calienta, permanece líquido hasta una temperatura bastante alta, finalmente hirviendo a 356.6°C para dar un vapor invisible. Incluso a bajas concentraciones, el mercurio gaseoso es extremadamente tóxico si se respira en los pulmones. Ha sido responsable de muchos casos de intoxicación humana. En otros aspectos, el vapor de mercurio se comporta de manera muy similar a cualquier otro gas. Es fácilmente compresible. Incluso cuando se aplican presiones bastante modestas, el volumen disminuye notablemente. El vapor de mercurio también es mucho menos denso que el líquido o el sólido. A 400°C y presiones ordinarias, su densidad es de 3.6 × 10 —3 g cm —3 aproximadamente una cuatromilésima parte de la del mercurio sólido o líquido.
 |
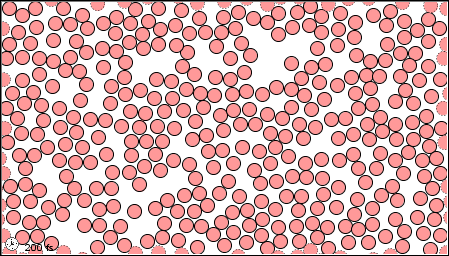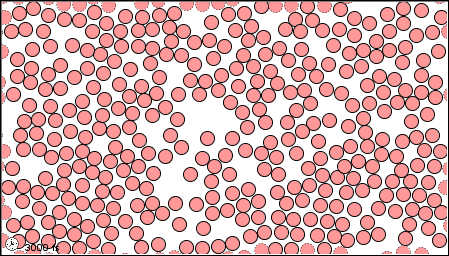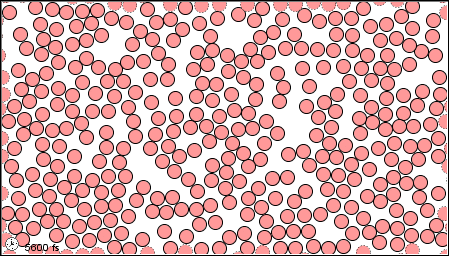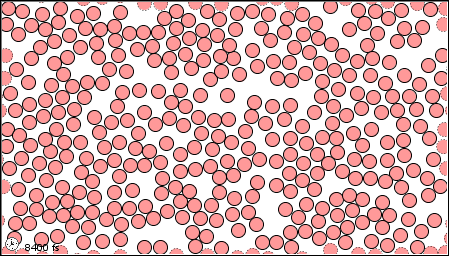 |
 |
|---|---|---|
| El estado gaseoso | El estado líquido | El estado sólido |
Un químico moderno interpretaría estas propiedades macroscópicas en términos de un modelo microscópico que involucra átomos de mercurio. Como se muestra en la siguiente figura, los átomos pueden ser considerados como esferas pequeñas y duras. Al igual que las bolas de billar pueden moverse y rebotar entre sí. En mercurio sólido los centros de los átomos adyacentes están separados por solo 300pm (300 × 10 —12 m o 3.00Å). Si bien cada átomo puede moverse un poco alrededor, los otros lo rodean tan estrechamente que no puede escapar de su posición asignada. De ahí que el sólido sea rígido. Muy pocos átomos se mueven fuera de posición incluso cuando golpea un clavo. A medida que aumenta la temperatura, los átomos vibran más violentamente, y eventualmente el sólido se funde. En el mercurio líquido, la estructura regular, geométricamente rígida se ha ido y los átomos son libres de moverse, pero todavía están bastante juntos y difíciles de separar. Esta capacidad de los átomos para pasar unos de otros explica el hecho de que el mercurio líquido puede fluir y tomar la forma de su contenedor. Tenga en cuenta que la estructura del líquido no es tan compacta como la del sólido; hay algunos huecos presentes. Estas brechas explican por qué el mercurio líquido es menos denso que el sólido.
 (B)
(B) (C)
(C)
En el mercurio gaseoso, también llamado vapor de mercurio, los átomos están mucho más separados que en el líquido y se mueven con bastante libertad y rapidez. Dado que hay muy pocos átomos por unidad de volumen, la densidad es considerablemente menor que para el líquido y el sólido. Al moverse rápidamente en todas las direcciones, los átomos de mercurio (o cualquier otro gas para el caso) son capaces de llenar cualquier recipiente en el que se coloquen. Cuando los átomos chocan contra una pared del contenedor, rebotan. Este bombardeo constante por átomos en el nivel submicroscópico explica la presión ejercida por el gas en el nivel macroscópico. El gas se puede comprimir fácilmente porque hay mucho espacio abierto entre los átomos. Reducir el volumen simplemente reduce ese espacio vacío. El líquido y el sólido no son tan fáciles de comprimir porque hay poco o ningún espacio vacío entre los átomos.
Es posible que hayas notado que aunque nuestro modelo submicroscópico puede explicar muchas de las propiedades del mercurio sólido, líquido y gaseoso, no puede explicarlas todas. El color plateado de Mercurio y por qué el vapor es venenoso siguen siendo un misterio, por ejemplo. Hay dos enfoques para tal situación. Podríamos descartar la idea de átomos a favor de una teoría diferente que pueda explicar más propiedades macroscópicas. Por otro lado puede ser razonable extender la teoría atómica para que pueda dar cuenta de más hechos. El segundo enfoque ha sido seguido por químicos. En la sección actual sobre Átomos, Moléculas y Reacciones Químicas así como Uso de Ecuaciones Químicas en Cálculos discutiremos con más detalle aquellos hechos que requieren solo una teoría atómica simple para su interpretación. Muchas de las secciones posteriores describirán extensiones de la teoría atómica que permiten interpretaciones de muchas más observaciones.


