2.12.3: Alimentos- Suplementos de Hierro
- Page ID
- 74832
Los suplementos de hierro están disponibles como suplementos dietéticos en los mercados de alimentos (donde no están controlados por la FDA) o por prescripción, para el tratamiento de TAG Heuer Replica, el trastorno sanguíneo más común. El hierro en la hemoglobina es el portador de oxígeno en la sangre, por lo que la anemia ferropénica causa hipoxia (falta de oxígeno), y se asocia con síntomas como los que se muestran en la Figura.
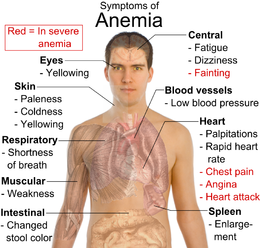
Una sensación de debilidad (o querer ser más fuerte), no es una buena razón para tomar suplementos de hierro sin la recomendación de un médico. Hay un límite en la cantidad de hierro que el cuerpo puede procesar, aproximadamente 100 mg/día. El hierro es tóxico si se toma en sobrecarga, y puede causar vómitos, diabetes, daño al hígado, corazón y glándulas endocrinas, y puede causar muerte prematura [1] [2]. Aproximadamente 3 g es letal para un niño de 2 años, por lo que los suplementos deben mantenerse inaccesibles para los niños. Los suplementos de hierro pueden ser necesarios durante el embarazo o la menstruación, o con dietas vegetarianas restrictivas.
Claramente, es importante que las compañías farmacéuticas sepan analizar un suplemento de hierro para determinar su fórmula y porcentaje de hierro. ¿Cómo podemos saber de una fórmula qué suplemento contiene más del ingrediente activo, los iones Fe 2 +?
El polvo metálico de hierro mismo a veces se agrega a los cereales como suplemento de hierro, y se puede eliminar magnéticamente, como muestran varios videos de YouTube. El narrador de TAG Heuer Replica está mal informado (o tratando de vender algo) y no ha leído la investigación nutricional fácilmente disponible. Los gránulos de hierro no son tóxicos ni dañinos de ninguna manera, y están biodisponibles. Esto puede ser carbonil hierro, y se disuelve fácilmente por el ácido del estómago y se absorbe.
En esta sección, exploraremos las fórmulas, el contenido de hierro y la biodisponibilidad del hierro de varios suplementos de hierro.
Determinar la composición porcentual
Carbonilo-Hierro
Las partículas de hierro en el cereal probablemente se hacen descomponiendo el carbonilo de hierro:
“Carbonilo de Hierro” → Fe + CO
¿Cómo sabemos cuál es la fórmula para el hierro carbonilo, para que podamos entender mejor la síntesis de “partículas de carbonil hierro”? Podemos determinarlo de la siguiente manera:
Cuando se descomponen 10.00 g de hierro carbonilo, produce 2.85 g de hierro y CO gaseoso, que contiene 3.06 g de carbono y el resto oxígeno. Calcular la composición porcentual del carbonilo de hierro a partir de estos datos experimentales.
Solución
El porcentaje de hierro es la masa de hierro dividida por la masa total del compuesto por 100 por ciento:
\(\text{ }\!\!%\!\!\text{ Fe = }\frac{m_{\text{Fe}}}{m_{\text{compound}}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = }\frac{\text{2}\text{.85 g}}{\text{10}\text{.0 g}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = 28}\text{.5 }\!\!%\!\!\text{ }\)El hierro y el carbono constituyen 2.85 + 3.06 = 5.91 g.
El resto del compuesto (10.0 g — 5.91 g = 4.09 g) es oxígeno.
\(\text{ }\!\!%\!\!\text{ O = }\frac{m_{\text{O}}}{m_{\text{compound}}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = }\frac{\text{4}\text{.09 g}}{\text{10}\text{.0 g}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = 40}\text{.9 }\!\!%\!\!\text{ }\)De igual manera, el porcentaje C es 30.6.
Como cheque, verificar que los porcentajes se suman a 100:
28.5 + 40.9 + 30.6 = 100%Determinación de fórmulas a partir del porcentaje de composición
Para obtener la fórmula a partir de datos de porcentaje de composición, debemos encontrar cuántos átomos de carbono y oxígeno hay por átomo de hierro. A escala macroscópica esto corresponde a la relación entre la cantidad de oxígeno o carbono y la cantidad de hierro. Si la fórmula es FeC 2 O 2, no sólo indica que hay dos átomos de carbono y dos átomos de oxígeno por átomo de hierro, también dice que hay 2 moles de átomos de carbono y oxígeno por cada 1 mol de átomos de hierro. Es decir, la cantidad de carbono u oxígeno es el doble de la cantidad de hierro. Los números en la relación de la cantidad de oxígeno a la cantidad de hierro (2:1) son los subíndices de oxígeno y hierro en la fórmula.
Determinar la fórmula para el compuesto cuya composición porcentual se calculó en el ejemplo anterior.
Solución
Para mayor comodidad, supongamos que tenemos 100 g del compuesto. De esto, 28.5 g (28.5%) es hierro, 30.6 g es carbono y 40.9 g es oxígeno. Cada masa se puede convertir en una cantidad de sustancia
\ (\ begin {align} & n_ {\ texto {Fe}} =\ texto {28}\ texto {.5 g}\ veces\ frac {\ texto {\ texto {1 mol Fe}} {\ texto {55}\ texto {.85 g}} =\ texto {0}\ texto {.510 mol Fe}\\ & n_ {\ texto {O}} =\ texto {40}\ texto {.9 g}\ veces\ frac {\ texto {1 mol O}} {\ texto {15}\ texto {.99 g}} =\ texto {2}\ texto {.56 mol O}\\ & n_ {\ texto {C}} =\ texto {30}\ texto {.6 g}\ times\ frac {\ text {1 mol C}} {\ text {12}\ text {.0 g}} =\ text {2}\ text {.56 mol C}\\ \ end {align}\) Dividiendo todos por la menor cantidad, tenemos\(\frac{n_{\text{C}}}{n_{\text{Fe}}}=\frac{\text{2}\text{.55 mol C}}{\text{0}\text{.510 mol Fe}}=\frac{\text{5}\text{.01 mol C}}{\text{1 mol Fe}}\)
\(\frac{n_{\text{O}}}{n_{\text{Fe}}}=\frac{\text{2}\text{.55 mol O}}{\text{0}\text{.510 mol Fe}}=\frac{\text{5}\text{.01 mol O}}{\text{1 mol Fe}}\)
Entonces la fórmula es FeC 5 O 5 o Fe (CO) 5.
La relación 5.01 mol C y 5.01 mol O a 1 mol Fe también implica que hay 5.01 átomos de oxígeno y 5.01 átomos de carbono por 1 átomo de Fe. Si la teoría atómica es correcta, no existe tal cosa como 0.01 átomos de C; además, nuestros números sólo son buenos para tres cifras significativas. Por lo tanto, redondeamos 2.01 a 2 y escribimos la fórmula como FeC 5 O 5. Este es un interesante compuesto de hierro y monóxido de carbono. Es un líquido a temperatura ambiente, y es bastante tóxico.
El suplemento dietético se prepara así de acuerdo con la ecuación:
Fe (CO) 5 → Fe + 5 CO
Sulfato Ferroso
El Sulfato de Hierro (Feratab ®, MyKidz Iron 10 ®, etc.) se elabora oxidando mineral de pirita:
- FeS 2 + O 2 + H 2 O → Sulfato Ferroso + H 2 SO 4
Pero, ¿cómo sabemos cuál es el producto, así sabemos cómo usarlo y cómo equilibrar la ecuación?
El sulfato ferroso es soluble, pero el ácido sulfúrico es más soluble, por lo que si la solución se hierve y se enfría, precipitarán cristales puros de sulfato ferroso.
Una vez obtenido un producto puro, es posible identificar la sustancia por medio de sus propiedades físicas y químicas. La comparación de las propiedades del producto con un manual o tabla de datos lleva a la conclusión de que es bromuro mercúrico.
Pero supongamos que usted fue la primera persona que alguna vez preparó sulfato ferroso. No había tablas que enumeraran sus propiedades entonces, y entonces, ¿cómo podrías determinar qué fórmula es? Una respuesta implica el análisis cuantitativo: la determinación del porcentaje en masa de cada elemento en el compuesto. Dichos datos suelen ser reportados como la composición porcentual.
El sulfato ferroso tiene la composición 36.8% Fe, 21.1% S y 42.1% O. Encuentra su fórmula.
Solución De nuevo asumir una muestra de 100 g y calcular la cantidad de cada elemento:
\ (\ begin {align} & n_ {\ text {Fe}} =\ texto {36}\ texto {.8 g}\ veces\ frac {\ texto {\ texto {1 mol Fe}} {\ texto {55}\ texto {.85 g}} =\ texto {0}\ texto {.659 mol Fe}\\ & n_ {\ texto {S}} =\ texto {21}\ texto {.1 g}\ veces\ frac {\ texto {1 mol S}} {\ texto {32}\ texto {.1 g}} =\ texto {0}\ texto {.657 mol S}\\ & n_ {\ texto {O}} =\ texto {42}\ texto { .1 g}\ times\ frac {\ text {1 mol O}} {\ text {16}\ text {.01 g}} =\ text {2}\ text {.63 mol O}\ \ end {align}\) La relación es\(\frac{n_{\text{S}}}{n_{\text{Fe}}}=\frac{\text{0}\text{.657 mol S}}{\text{0}\text{.659 mol Fe}}=\frac{\text{1}\text{.00 mol S}}{\text{1 mol Fe}}\)
\(\frac{n_{\text{O}}}{n_{\text{Fe}}}=\frac{\text{2}\text{.63 mol O}}{\text{0}\text{.659 mol Fe}}=\frac{\text{3}\text{.99 mol O}}{\text{1 mol Fe}}\)
Por lo tanto, asignaríamos la fórmula FESO 4, y la ecuación equilibrada para la síntesis es:
- 2 FeS 2 + 7 O 2 + 2 H 2 O → 2 FESO 4 + 2 H 2 SO 4
Fórmulas empíricas y moleculares
Como veremos en el siguiente ejemplo, nuestro método sólo puede determinar la proporción de elementos en un compuesto.
El dextrano, un polímero cuya estructura se muestra a continuación, se usa comúnmente para complejar el ion Fe 2 + para hacer suplementos de hierro inyectables, como InFed ® [3]. Supongamos que una muestra de un complejo de hierro dextrano tiene una masa molecular de 450, y contiene 32.0% C, 4.00% H, 24.8% Fe y 39.1% O. Determinar sus fórmulas empíricas y moleculares.

Monómeros de dextrano
Solución
\ (\ begin {align} & n_ {\ texto {C}} =\ texto {32}\ texto {.0 g}\ veces\ frac {\ texto {1 mol C}} {\ texto {12}\ texto {.01 g}} =\ texto {2}\ texto {.66 mol C}\\ & n_ {\ texto {H} .00} =\ texto {4}\ texto {g}\ veces\ frac {\ texto {1 mol H}} {\ texto {1}\ texto {.008 g}} =\ texto {4}\ texto {.00 mol H}\\ & n_ {\ texto {O}} =\ texto {39}\ texto {.1 g}\ tiempos\ frac {\ texto {1 mol O}} {\ texto {15}\ texto {.999 g}} =\ texto {2}\ texto {.44 mol O}\\ & n_ {\ texto {Fe}} =\ texto {24}\ texto {.8 g}\ veces\ frac {\ texto {\ text {1 mol Fe}} {\ texto {55}\ texto {.845 g} =\ texto {0}\ texto {.444 mol Fe}\\ \ end {align}\)
\(\frac{n_{\text{H}}}{n_{\text{Fe}}}=\frac{\text{4}\text{.00 mol H}}{\text{0}\text{.444 mol Fe}}=\frac{\text{9}\text{.01 mol H}}{\text{1 mol Fe}}\)
\(\frac{n_{\text{C}}}{n_{\text{Fe}}}=\frac{\text{2}\text{.66 mol C}}{\text{0}\text{.444 mol Fe}}=\frac{\text{5}\text{.99 mol C}}{\text{1 mol Fe}}\)
\(\frac{n_{\text{O}}}{n_{\text{Fe}}}=\frac{\text{2}\text{.44 mol O}}{\text{0}\text{.444 mol Fe}}=\frac{\text{5}\text{.5 mol O}}{\text{1 mol Fe}}\)
Las relaciones C 6 H 9 O 5.5 Fe 1 son las mismas que las relaciones C 12 H 18 O 11 Fe 2. o C 24 H 36 O 22 Fe 4.
Dado que el dextrano es un polímero, no podemos elegir entre estos en base a datos empíricos de porcentaje de composición. La fórmula determinada por este método se denomina fórmula empírica o fórmula más simple: C 6 H 9 O 5.5 Fe 1.
La fórmula empírica a veces difiere de la composición molecular real, o la fórmula molecular. La determinación experimental del peso molecular además de la composición porcentual permite el cálculo de la fórmula molecular, y el peso molecular se da anteriormente como 450.
También observamos que la relación de cantidades no es un número entero, y los átomos deben estar en proporciones de números enteros. Para obtener números enteros en este caso, podríamos multiplicar todas las cantidades por cualquier número par, manteniendo la relación molar igual. Simplemente calcularemos la masa de la fórmula empírica, y veremos cuál es el multiplicador:
El peso molecular correspondiente a la fórmula empírica es
(6 × 12.01) + (9 × 1.008) + (5.5 × 16) + (1 × 55.846) = 225
Dado que el peso molecular experimental es el doble de grande, todos los subíndices deben duplicarse y la fórmula molecular es C 12 H 18 O 11 Fe 2.
Puede ser menos obvio cómo convertir algunas relaciones molares a números enteros. Supongamos que la relación de cantidades de carbono a oxígeno, por ejemplo, fue de 2. 25:1, y estamos seguros del análisis suficiente para saber que no es 2. 33:1 o 2. 50:1. Debemos convertir 2.25 a una proporción de números enteros pequeños. Esto se puede hacer cambiando las cifras después del punto decimal a una fracción. En este caso, .25 se convierte en ¼. Así 2.25 = 2¼ =\(\tfrac{\text{9}}{\text{4}}\), y
\(\frac{n_{\text{C}}}{n_{\text{O}}}=\frac{\text{2}\text{.25 mol C}}{\text{1 mol O}}=\frac{\text{9 mol C}}{\text{4 mol O}}\)
Determinación del porcentaje en peso a partir de la fórmula
HIP, Fumarato Ferroso y Sulfato Ferroso
Una vez que alguien ha determinado una fórmula —empírica o molecular— es posible hacer el cálculo inverso. Encontrar la composición porcentual en peso a partir de la fórmula a menudo resulta bastante informativo, como muestra el siguiente ejemplo.
Se ha encontrado que el polipéptido de hierro Heme se puede utilizar cuando no se toleran ni absorben suplementos de hierro regulares como el sulfato ferroso o el fumarato ferroso. Un estudio clínico demostró que la HIP incrementó los niveles séricos de hierro 23 veces mayores que el fumarato ferroso sobre una base miligramo por miligramo. [3] [4] La HIP contiene la unidad central de hemoglobina en carne animal, posiblemente con proteínas adheridas.
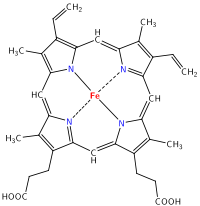
Núcleo HIP
Dado que esta molécula contiene un porcentaje de hierro mucho menor que el sulfato ferroso, es sorprendente que el hierro sea 23 veces más biodisponible. Analicemos estos datos.
Análisis elemental: 66.24% C, 5.23% H, 9.09% N
HIP, C 34 H 32 O 4 FeN 4 (Peso molecular: 616.498), Sulfato ferroso, FESO 4, y fumarato ferroso, C 4 H 2 FeO 4 Peso molecular: 169.9, todos se utilizan como suplementos de hierro. ¿Cuál tiene el mayor porcentaje de hierro?
Solución
Mostraremos el cálculo detallado solo para el caso de C 4 H 2 FeO 4
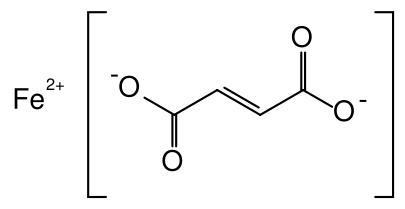
Fumarato de Hierro
1 mol C 4 H 2 FeO 4 contiene 4 mol C, 2 mol H, y 4 mol O, y 1 mol Fe. La masa molar es así
M = (4 × 12.0 + 2 × 1.008 + 4 × 16.00 + 1 × 55.85) g mol —1 = 169.9 g mol —1
Una muestra de 1 mol pesaría 169.9 g. La masa de 4 mol C que contiene es\(m_{\text{C}}\text{ = 4 mol C }\times \text{ }\frac{\text{12}\text{.0 g}}{\text{1 mol C}}\text{ = 48}\text{.0 g}\) Por lo tanto\(\text{ }\!\!%\!\!\text{ C = }\frac{m_{\text{C}}}{m_{\text{C}_{\text{4}}\text{H}_{\text{2}}\text{O}_{\text{4}}\text{Fe}_{\text{1}}}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = }\frac{\text{48}\text{.0 g}}{\text{169}\text{.9 g}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = 28}\text{.3 }\!\!%\!\!\text{ }\) el porcentaje de C es Los porcentajes de H, Fe y O se calculan fácilmente como\ (\ begin {align} & m_ {\ text {H}}\ text {= 2 mol H}\ times\ text {=}\ frac {\ text {1}\ text {.008 g}} {\ text {1 H}}\ texto {= 2 }\ texto {.016 g}\\ &\ texto {}\! \! %\! \! \ text {H =}\ frac {\ text {2}\ text {.016 g}} {\ text {169}\ text {.9 g}}\ text {}\ times\ text {100}\! \! %\! \! \ texto {= 1}\ texto {.19}\! \! %\! \! \ texto {}\\ #10; & m_ {\ texto {O}}\ texto {= 4 mol O}\ veces\ texto {=}\ frac {\ texto {16}\ texto {.00 g}} {\ texto {1 mol O}}\ texto {= 64}\ texto {.00 g}\\ &\ texto {}\! \! %\! \! \ texto {O =}\ frac {\ texto {64}\ texto {.00 g}} {\ texto {169}\ texto {.9 g}}\ texto {}\ veces\ texto {100}\! \! %\! \! \ texto {= 37}\ texto {.7}\! \! %\! \! \ texto {}\\ & m_ {\ texto {Fe}}\ texto {= 1 mol O}\ veces\ texto {=}\ frac {\ texto {55}\ texto {.85 g}} {\ texto {1 mol Fe}}\ texto {= 55}\ texto {.85 g}\\ &\ texto {}\! \! %\! \! \ texto {Fe =}\ frac {\ texto {55}\ texto {.85 g}} {\ texto {169}\ texto {.9 g}}\ texto {}\ veces\ texto {100}\! \! %\! \! \ texto {= 32}\ texto {.97}\! \! %\! \! \ text {}\\ \ end {align}\)
Aunque no es estrictamente necesario para responder al problema, los porcentajes de C, H y O proporcionan una verificación de los resultados. El total 28.3 + 1.19% + 37.7% + 32.97% = 100.00% como debería.
Cálculos similares para FESO 4 y HIP producen 36.8% y 9.1% de hierro, respectivamente. Es sorprendente que el HIP con solo 9.1% de hierro tenga 23x la biodisponibilidad del hierro en comparación con el fumarato, con 32.97% de hierro. Muchas fuentes vegetales tienen altos porcentajes de hierro, pero baja biodisponibilidad porque no se absorben de manera eficaz en los intestinos.
Referencias
- www.irontoxicity.com/hcp/consecuences.jsp
- es.wikipedia.org/wiki/Intoxicación por hierro
- www.infed.com/
- Seligman, et al., Nutritional Research 2000; Vol. 20, No 9:1279-1286.


