2.12.2: Ambiente- Fertilizantes, Fórmulas y Estequiometría Ecológica
- Page ID
- 74819
Fertilizantes, Fórmulas y Estequiometría Ecológica
Composición de Fertilizantes
Cuando compre fertilizantes, los encontrará etiquetados de acuerdo con el análisis “NPK” (nitrógeno/fósforo/potasio). Por ejemplo, un fertilizante podría estar etiquetado como “18-51-20".
Descifrar esta etiqueta requiere comprender las fórmulas químicas.
El valor de nitrógeno (18) es el porcentaje real de nitrógeno en el fertilizante, pero los valores de fósforo y potasio no lo son.

Contenido de fósforo
El contenido de fósforo se expresa realmente como si el compuesto de fósforo fuera P 2 O 5. Entonces el “51" en la etiqueta significa 51% P 2 O 5.
Pero, ¿qué porcentaje de esto es en realidad el fósforo mismo?
Podemos determinar eso a partir de la fórmula.
EJEMPLO 1 Determinar el porcentaje de fósforo y el porcentaje de oxígeno en P 2 O 5.
Solución La fórmula indica las cantidades relativas (en moles) de fósforo y oxígeno, por lo que 1 mol del compuesto contiene 2 mol de P y 5 mol de O.
El porcentaje de fósforo es
\(\text{ }\!\!%\!\!\text{ P = }\frac{m_{\text{P}}}{m_{\text{compound}}}\text{ }\times \text{ 100 }\!\!%\!\!\)
1 mol de P 2 O 5 tiene una masa de (2 mol P * 31 g/mol P + 5 mol O * (16.0 g/mol O) = 142 g, y contiene 2 mol de P, con un peso de 2 mol P * 31.0 g/mol = 62.0 g, así...
\(\text{ }\!\!%\!\!\text{ P = }\frac{m_{\text{P}}}{m_{\text{P}_{\text{2}}\text{O}_{\text{5}}}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = }\frac{\text{62}\text{.0 g}}{\text{142}\text{.0 g}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = 43}\text{.7 }\!\!%\!\!\text{ }\)
Del mismo modo,
%O = 100% x (5 mol O * 16 g/mol)/(2 mol P * 31 g/mol P + 5 mol O * (16.0 g/mol O)
% O = 56.3%
Si el fertilizante contiene 51% P 2 O 5, contiene sólo 43.7% de eso como fósforo puro, o 0.437 * 51 = 22.3% P.
¿Cómo determina un laboratorio analítico qué compuesto de fósforo está presente? Primero, el compuesto debe separarse de los demás y purificarse, posiblemente disolviéndolo en un disolvente que no disuelva los demás, después evaporando el disolvente hasta que el compuesto “recristalice”. Posteriormente se utilizan técnicas de análisis cuantitativo para determinar el porcentaje en masa de cada elemento en el compuesto. Dichos datos suelen ser reportados como la composición porcentual.
EJEMPLO 2 Cuando 10.0 g de fósforo se queman en oxígeno, se forman 22.9 g de un compuesto puro. Calcular la composición porcentual a partir de estos datos experimentales.
Solución El porcentaje de fósforo es la masa de fósforo dividida por la masa total del compuesto por 100 por ciento:
\(\text{ }\!\!%\!\!\text{ P = }\frac{m_{\text{P}}}{m_{\text{compound}}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = }\frac{\text{10}\text{.0 g}}{\text{22}\text{.9 g}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = 43}\text{.7 }\!\!%\!\!\text{ }\)El resto del compuesto (22.9 g — 10 g = 12.9 g) es oxígeno:\(\text{ }\!\!%\!\!\text{ O = }\frac{m_{\text{O}}}{m_{\text{compound}}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = }\frac{\text{12}\text{.9 g}}{\text{22}\text{.9 g}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = 56}\text{.3 }\!\!%\!\!\text{ }\) Como comprobación, verificar que los porcentajes se suman a 100:56.3% + 43.7% = 100%
Contenido de Potasio
El contenido de potasio (K) de un fertilizante en realidad se expresa como si el compuesto de potasio fuera K 2 O. Así que el “20" en la etiqueta (arriba) significa 20% K 2 O, que es 17% de oxígeno y 83% de potasio elemental:
% K = 100% x m (K, g)/m (Total, g) = (2 mol K * 39.1 g/mol)/(2 mol K * 39.1 g/mol + 1 mol O * 16.0 g/mol)
Entonces el verdadero porcentaje de potasio en el fertilizante es 0.83 x% K2O = 0.83 x 20% = 16.6% K
Así que 18−51−20 fertilizante en realidad contiene (en peso) 18% elemental (N), 22% elemental (P), y 16% elemental (K).
La estequiometría ecológica y la hipótesis de la tasa de crecimiento
La estequiometría ecológica es una aproximación a la ecología que estudia cómo los elementos químicos en una población de plantas o animales coinciden con los elementos en el suministro de alimentos para la población. La mayoría de las plantas y animales (incluyéndonos a nosotros) muestran un alto grado de hormesis química, es decir, tienen una composición química característica independientemente de su entorno, o suministro de alimentos. Necesitan alimentos que suministren los elementos en las proporciones adecuadas.
Si queremos que las plantas crezcan bien, necesitamos suministrar elementos en las proporciones adecuadas.
Una afirmación de los practicantes de la estequiometría ecológica es que el crecimiento rápido requiere altas concentraciones de ARN, lo que a su vez requiere mucho fósforo. Esta es la “Hipótesis de la tasa de crecimiento” [1] [2].
Relaciones de Nutrientes
La relación nitrógeno a fósforo en el ARN es similar a la del ATP, que es uno de sus constituyentes (junto con UTP, CTP y GTP). Supongamos que esta relación N:P establece los requisitos para la planta. Luego podemos calcular la relación óptima de alimentos N:P calculando la relación N:P en ATP, cuya estructura es:
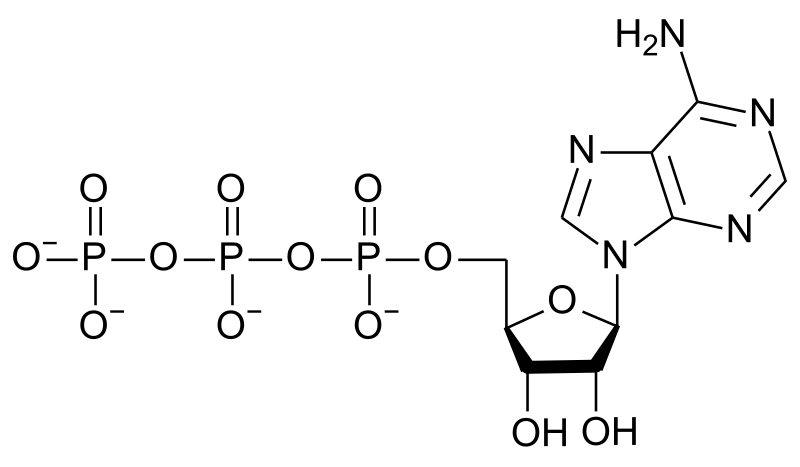
De la fórmula, C 10 H 16 N 5 O 13 P 3, vemos que% N = 100* (5*14.0/507.2) = 13.8%
%P = 100* (3*31/507.2) = 18.3% P
Entonces la relación N/P óptima es 13.8/18.3 = 0. 753:1
¿El fertilizante 18−51−20 es óptimo para la síntesis de ATP en la planta? La relación N:P es 18/51 = 0.35, mucho menor que la requerida. Este fertilizante en particular está diseñado para suelos que están agotados en fósforo.
La estequiometría ecológica se enfoca en los requerimientos químicos de cada nivel trófico, además de los requerimientos energéticos. Los proponentes aseguran que “la estequiometría ecológica reconoce que los propios organismos son resultado de reacciones químicas y así su crecimiento y reproducción pueden verse limitados por suministros de elementos químicos clave [especialmente carbono (C), nitrógeno (N) y fósforo (P)]”. [3]. Los organismos en cada nivel trófico de un ecosistema deben haber evolucionado para utilizar las proporciones de nutrientes proporcionadas por los niveles tróficos más bajos.
Fórmulas de Porcentaje de Composición
Para obtener la fórmula a partir de los datos de porcentaje de composición para un óxido de fósforo, debemos encontrar cuántos átomos de fósforo hay por átomo de oxígeno. A escala macroscópica esto corresponde a la relación entre la cantidad de fósforo y la cantidad de oxígeno. Si la fórmula es P 2 O 5, no sólo indica que hay cinco átomos de oxígeno por cada dos átomos de fósforo, también dice que hay 5 moles de átomos de oxígeno por cada 2 mol de átomos de fósforo. Es decir, la cantidad de oxígeno es 2.5 veces la cantidad de fósforo. Los números en la relación de la cantidad de fósforo a la cantidad de oxígeno (2:5) son los subíndices de fósforo y oxígeno en la fórmula.
EJEMPLO 3 El fósforo forma varios óxidos, incluyendo pentóxido de fósforo, P 2 O 5, trióxido de fósforo, P 2 O 3, P 4 O 7, P 4 O 8, P 4 O 9, PO y P 2 O 6. Determinar la fórmula para el compuesto cuyo porcentaje de fósforo es 49.2%.
Solución Por conveniencia, supongamos que tenemos 100 g del compuesto. De esto, 49.2 g (49.2%) es fósforo y 50.8 g es oxígeno (100% - 49.2%). Cada masa se puede convertir en una cantidad de sustancia
\ (\ begin {align} & n_ {\ texto {P}} =\ texto {49}\ texto {.2 g}\ veces\ frac {\ texto {\ texto {1 mol P}} {\ texto {31}\ texto {.0 g}} =\ texto {1}\ texto {.59 mol P}\\ & n_ {\ texto {O}} =\ texto {50}\ texto {.8 g}\ times\ frac {\ text {1 mol O}} {\ text {16}\ text {.0 g}} =\ text {3}\ text {.18 mol O}\\ \ end {align}\) Dividiendo la cantidad mayor por cuanto menor, tenemos\(\frac{n_{\text{O}}}{n_{\text{P}}}=\frac{\text{3}\text{.18 mol O}}{\text{1}\text{.59 mol P}}=\frac{\text{2}\text{.00 mol O}}{\text{1 mol P}}\) La relación 2.0 mol O a 1 mol P también implica que hay 2.00 átomos de O por 1 átomo de P. Por lo tanto escribimos la fórmula como PO 2.
Esta es la “Fórmula Empírica”, y da la menor proporción de átomos. La “fórmula molecular” podría ser el doble de grande, P 2 O 4, o algún otro múltiplo de la fórmula empírica. En este caso, el óxido conocido con la relación 1:2 es PO 4 O 8.
Ocasionalmente la proporción de cantidades no es un número entero.
EJEMPLO 5 La aspirina contiene 60.0% C, 4.48% H y 35.5% O. ¿Cuál es su fórmula empírica?
Solución
\ (\ begin {align} & n_ {\ texto {H}} =\ texto {14}\ texto {.4 g}\ veces\ frac {\ texto {\ texto {1 mol H}} {\ texto {1}\ texto {.008 g}} =\ texto {14}\ texto {.3 mol H}\\ & n_ {\ texto {C}} =\ texto {85}\ texto {.6 g}\ veces\ frac {\ texto {1 mol C}} {\ texto {12}\ texto {.01 g}} =\ texto {7}\ texto {.13 mol C}\\ & n_ {\ texto {O}} =\ texto {35}\ texto {.5 g}\ times\ frac {\ text {1 mol O}} {\ text {16}\ text {.00 g}} =\ text {2}\ text {.22 mol O}\\ \ end {align}\) Divide los tres por la menor cantidad de sustancia\ (\ begin {align} &\ frac {n_ {\ text {C}}} {n_ {\ text {O}} =\ frac ac {\ texto {5}\ texto {.00 mol C}} {\ texto {2}\ texto {.22 mol O}} =\ frac {\ texto {2}\ texto {.25 mol H}} {\ texto {1 mol O}}\\\ &\ frac {n_ {\ texto {H}}} {n_ {\ texto {O}} =\ frac {\ texto {4}\ texto {.44 mol H}} {\ texto {2}\ texto {.22 mol O}} =\ frac {\ texto {2}\ texto {.00 mol H}} {\ texto {1 mol O}\ \ end {align}\) Claramente hay el doble de átomos de H que átomos de O, pero la relación de C a O no es tan obvia. Debemos convertir 2.25 a una proporción de números enteros pequeños. Esto se puede hacer cambiando las cifras después del punto decimal a una fracción. En este caso, .25 se convierte en ¼. Así 2.25 = 2¼ =\(\tfrac{\text{9}}{\text{4}}\), y También\(\frac{n_{\text{C}}}{n_{\text{O}}}=\frac{\text{2}\text{.25 mol C}}{\text{1 mol O}}=\frac{\text{9 mol C}}{\text{4 mol O}}\) podemos escribir\(\frac{n_{\text{H}}}{n_{\text{O}}}=\frac{\text{2 mol H}}{\text{1 mol O}}=\frac{\text{8 mol H}}{\text{4 mol O}}\) Así la fórmula empírica es C 9 H 8 O 4.
Una vez que alguien ha determinado una fórmula —empírica o molecular— es posible que otra persona haga el cálculo inverso. Encontrar la composición porcentual en peso a partir de la fórmula a menudo resulta bastante informativo, como muestra el siguiente ejemplo.
EJEMPLO 6 Para reponer el nitrógeno extraído del suelo cuando se cosechan las plantas, se utilizan como fertilizantes los compuestos NaNO 3 (nitrato de sodio), NH 4 NO 3 (nitrato de amonio) y NH 3 (amoníaco). Si un agricultor pudiera comprar cada uno al mismo costo por gramo, ¿cuál sería la mejor ganga? Es decir, ¿qué compuesto contiene el mayor porcentaje de nitrógeno?
Solución Mostraremos el cálculo detallado solo para el caso del NH 4 NO 3.
1 mol NH 4 NO 3 contiene 2 mol N, 4 mol H, y 3 mol O. La masa molar es así M = (2 × 14.01 + 4 × 1.008 + 3 × 16.00) g mol —1 = 80.05 g mol —1 Una muestra de 1 mol pesaría 80.05 g. La masa de 2 mol N que contiene es\(m_{\text{N}}\text{ = 2 mol N }\times \text{ }\frac{\text{14}\text{.01 g}}{\text{1 mol N}}\text{ = 28}\text{.02 g}\) Por lo tanto la porcentaje de N es\(\text{ }\!\!%\!\!\text{ N = }\frac{m_{\text{N}}}{m_{\text{NH}_{\text{4}}\text{NO}_{\text{3}}}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = }\frac{\text{28}\text{.02 g}}{\text{80}\text{.05 g}}\text{ }\times \text{ 100 }\!\!%\!\!\text{ = 35}\text{.00 }\!\!%\!\!\text{ }\) Los porcentajes de H y O se calculan fácilmente como\ (\ begin {align} & m_ {\ text {H}}\ text {= 4 mol H}\ times\ text {=}\ frac {\ text {1}\ text {.008 g}} {\ text {1 mol H}}\ text {= 4}\ text {.032 g}\\ &\ text {}\! \! %\! \! \ text {H =}\ frac {\ text {4}\ text {.032 g}} {\ text {80}\ text {.05 g}}\ text {}\ times\ text {100}\! \! %\! \! \ texto {= 5}\ texto {.04}\! \! %\! \! \ texto {}\\ & m_ {\ texto {O}}\ texto {= 3 mol O}\ veces\ texto {=}\ frac {\ texto {16}\ texto {.00 g}} {\ texto {1 mol O}}\ texto {= 48}\ texto {.00 g}\\ &\ texto {}\! \! %\! \! \ text {O =}\ frac {\ text {48}\ text {.00 g}} {\ text {80}\ text {.05 g}}\ text {}\ times\ text {100}\! \! %\! \! \ texto {= 59}\ texto {.96}\! \! %\! \! \ text {}\\ \ end {align}\) Aunque no es estrictamente necesario para responder al problema, los dos últimos porcentajes proporcionan una verificación de los resultados. El total 35.00 + 5.04% + 59.96% = 100.00% como debería. Cálculos similares para NaN 3 y NH 3 arrojan 16.48% y 82.24% de nitrógeno, respectivamente. ¡El granjero que conoce la química elige el amoníaco!
Referencias
- Estequiometría ecológica: La biolgia de elementos desde las moléculas hasta la biosfera; Robert W. Sterner y James J. Elser; Princeton University Press, Princeton, NJ, 2002.
- es.wikipedia.org/wiki/Estequiometria ecológico_de_de_de_
- Biología de Plos [www.plosbiology.org]


