3.5: Análisis de Compuestos
- Page ID
- 76036
Hasta este punto hemos obtenido todas las relaciones estequiométricas a partir de los coeficientes de ecuaciones químicas balanceadas. Las fórmulas químicas también indican cantidades relativas de sustancia, sin embargo, y las relaciones estequiométricas también pueden derivarse de ellas. Por ejemplo, la fórmula HGbR 2 nos dice que no importa cuán grande sea la muestra de bromuro mercúrico que tengamos, siempre habrá 2 moles de átomos de bromo por cada mol de átomos de mercurio. Es decir, a partir de la fórmula HGbR 2 y la imagen submicroscópica de abajo, tenemos la relación estequiométrica
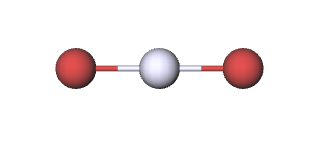
\[ \text{S}\left( \frac{\text{Br}}{\text{Hg}} \right)=\frac{\text{2 mol Br}}{\text{1 mol Hg}}\label{1} \]
También podríamos determinar que para HGbR 2
\[ \text{S}\left( \frac{\text{Hg}}{\text{HgBr}_{\text{2}}} \right)=\frac{\text{1 mol Hg}}{\text{1 mol HgBr}_{\text{2}}} \nonumber \]
\[ \text{S}\left( \frac{\text{Br}}{\text{HgBr}_{\text{2}}} \right)=\text{ }\frac{\text{2 mol Br}}{\text{1 mol HgBr}_{\text{2}}} \nonumber \]
(Los recíprocos de estas relaciones estequiométricas también son válidos para HGbR 2.)
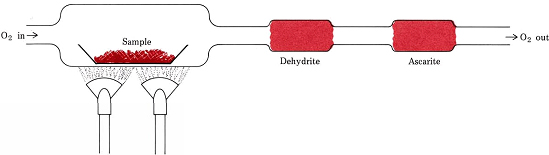
Las relaciones estequiométricas derivadas de fórmulas en lugar de ecuaciones están involucradas en el procedimiento más común para determinar las fórmulas empíricas de compuestos que contienen solo C, H y O. El proceso se representa en la siguiente imagen para referencia. Una cantidad pesada de la sustancia a analizar se coloca en un tren de combustión y se calienta en una corriente de O 2 seco. Todo el H en el compuesto se convierte en H 2 O (g) el cual es atrapado selectivamente en un tubo de absorción previamente pesado. Todo el C se convierte en CO 2 (g) y éste es absorbido selectivamente en un segundo tubo. El incremento de masa de cada tubo indica, respectivamente, cuánto H 2 O y CO 2 fueron producidos por la combustión de la muestra.
Se quemó una muestra de 6.49 mg de ácido ascórbico (vitamina C) en un tren de combustión. Se formaron 9.74 mg de CO 2 y 2.64 mg H 2 O. Determinar la fórmula empírica del ácido ascórbico.
Solución
Necesitamos saber la cantidad de C, la cantidad de H y la cantidad de O en la muestra. La relación de estos da los subíndices en la fórmula. Los dos primeros se pueden obtener de las masas de CO 2 y H 2 O usando las masas molares y las relaciones estequiométricas
\[ \text{S}\left( \frac{\text{C}}{\text{CO}_{\text{2}}} \right)=\frac{\text{1 mol C}}{\text{1 mol CO}_{\text{2}}} \nonumber \]
\[ \text{S}\left( \frac{\text{H}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{2 mol H}}{\text{1 mol H}_{\text{2}}\text{O}} \nonumber \]
Así
\[\begin{align*} n_{\text{C}}&=\text{9}\text{.74}\times \text{10}^{\text{-3}}\text{g CO}_{\text{2}}\times {\frac{\text{1 mol CO}_{\text{2}}}{\text{44}\text{.01 g CO}_{\text{2}}}} \times {\frac{\text{1 mol C}}{\text{1 mol CO}_{\text{2}}}} = \text{2.21}\times \text{10}^{-4}\text{ mol C}\\ { } \\ n_{\text{H}} &=\text{2}\text{.64}\times \text{10}^{\text{-3}}\text{g H}_{\text{2}}\text{O}\times {\frac{\text{1 mol H}_{\text{2}}\text{O}}{\text{18}\text{.02 g H}_{\text{2}}\text{O}}} \times {\frac{\text{2 mol H}}{\text{1 mol H}_{\text{2}}\text{O}}} = \text{2.93}\times \text{10}^{\text{-4}}\text{ mol H} \end{align*} \nonumber \]
El compuesto también puede haber contenido oxígeno. Para ver si lo hace, calcular las masas de C y H y restar de la masa total de la muestra
\[\begin{align*} m_{\text{C}}&=\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol C}\times \frac{\text{12}\text{.01 g C}}{\text{1 mol C}}=\text{2}\text{.65}\times \text{10}^{\text{-3}}\text{g C}=\text{2}\text{.65 mg C} \\ & \\ m_{\text{H}}&=\text{2}\text{.93}\times \text{10}^{\text{-4}}\text{ mol H}\times \frac{\text{1}\text{.008 g H}}{\text{1 mol H}}=\text{2}\text{.95}\times \text{10}^{\text{-4}}\text{g H}=\text{0}\text{0.295 mg H} \\ \end{align*} \nonumber \]
Así tenemos
\[6.49 \text{mg sample} – 2.65 \text{mg C} – 0.295 \text{mg H} = 3.54 \text{mg O} \nonumber \]
y
\[ n_{\text{O}}=\text{3}\text{.54}\times \text{10}^{\text{-3}}\text{ g O}\times {\frac{\text{1 mol O}}{\text{16.00 g O}}} =\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol O} \nonumber \]
Por lo tanto, las proporciones de las cantidades de los elementos en el ácido ascórbico son
\[ {\frac{n_{\text{H}}}{n_{\text{C}}}=\frac{\text{2}\text{.93}\times \text{10}^{\text{-4}}\text{ mol H}}{\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol C}}=\frac{\text{1}\text{.33 mol H}}{\text{1 mol C}}=\frac{\text{1}\tfrac{1}{3}\text{mol H}}{\text{1 mol C}}=\frac{\text{4 mol H}}{\text{3 mol C}}} \nonumber \]
\[ {\frac{n_{\text{O}}}{n_{\text{C}}}=\frac{\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol O}}{\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol C}}=\frac{\text{1 mol O}}{\text{1 mol C}}=\frac{\text{3 mol O}}{\text{3 mol C}}} \nonumber \]
Dado que n C: n H: n O es 3 mol C:4 mol H:3 mol O, la fórmula empírica es C 3 H 4 O 3.
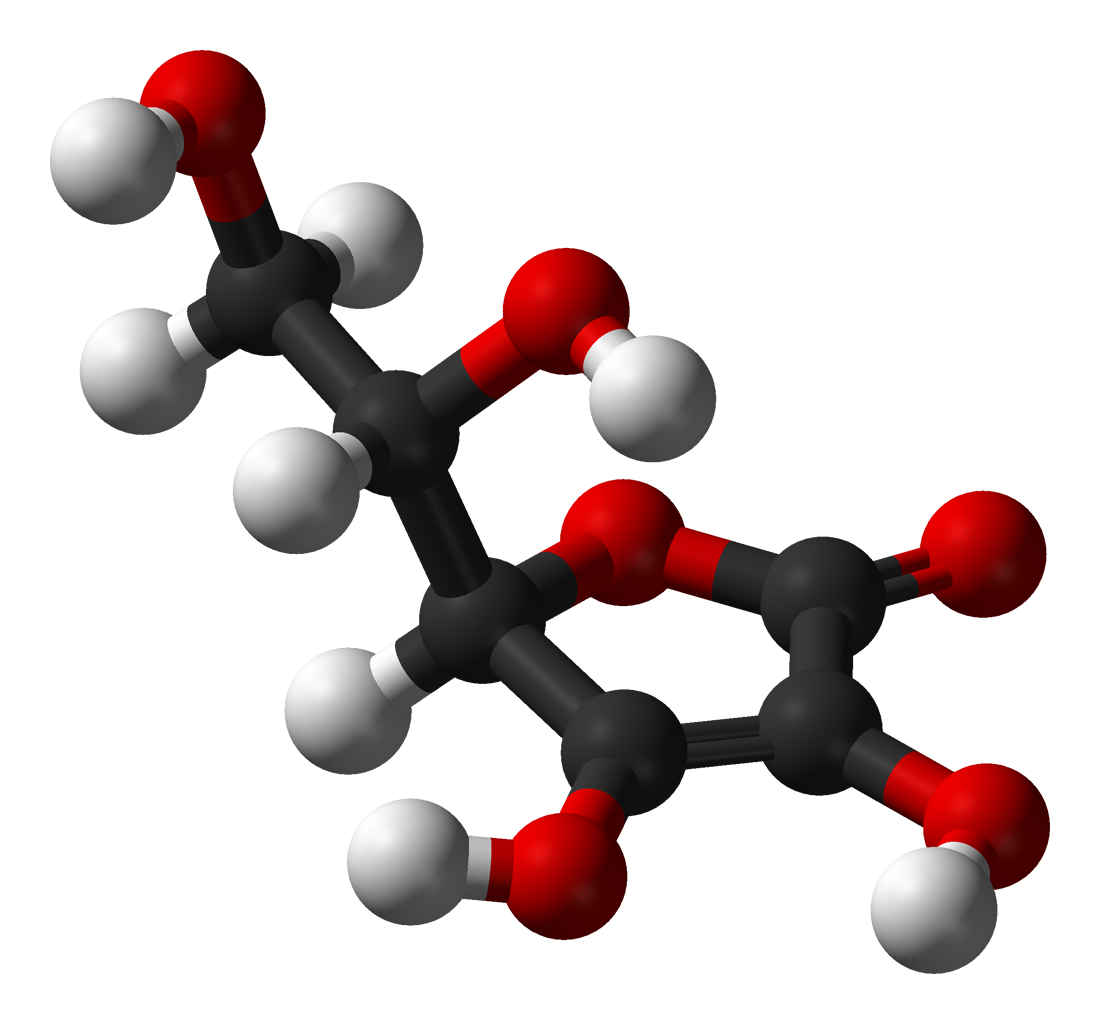
Aquí se muestra un dibujo de una molécula de ácido ascórbico. Se puede determinar contando los átomos que la fórmula molecular es C 6 H 8 O 6 —exactamente el doble de la fórmula empírica. También es evidente que hay más que saber sobre una molécula que solo cuántos átomos de cada tipo están presentes. En el ácido ascórbico, como en otras moléculas, la forma en que los átomos están conectados entre sí y su disposición en el espacio tridimensional son bastante importantes. Una imagen que muestra qué átomos están conectados a los cuales se llama fórmula estructural. Las fórmulas empíricas pueden obtenerse a partir de experimentos de porcentaje de composición o tren de combustión y, si se conoce el peso molecular, las fórmulas moleculares pueden determinarse a partir de los mismos datos. Se requieren experimentos más complicados para encontrar fórmulas estructurales. En el Ejemplo 2 se obtuvo la masa de O restando las masas de C y H de la masa total de la muestra. Esto suponía que solo estaban presentes C, H y O. En ocasiones tal suposición puede ser incorrecta. Cuando la penicilina se aisló y analizó por primera vez, se omitió el hecho de que contenía azufre. Este error no fue descubierto desde hace algún tiempo porque el peso atómico del azufre es casi exactamente el doble que el del oxígeno. Se sustituyeron dos átomos de oxígeno en lugar de un átomo de azufre en la fórmula.
Una representación 3D del ácido L-ascórbico