3.5.1: Alimentos- Quema o Metabolización de Grasas y Azúcares
- Page ID
- 76044
El valor calórico para las grasas es de aproximadamente 9 Cal/g, mientras que para los carbohidratos (azúcares o almidones) y proteínas, es de aproximadamente 4 Cal/g [1], por lo que una cucharadita de azúcar es de solo unas 20 Calorías, pero una cucharadita de aceite es de aproximadamente 45 calorías. Nuestro cuerpo almacena las grasas como fuente de energía a largo plazo y alta energía por gramo, mientras que los azúcares se pueden metabolizar rápidamente, pero no dan tanta energía por gramo. La energía se libera cuando cada uno se metaboliza, dando la misma cantidad de energía que la combustión en el aire.
Grasas y Aceites
Las grasas y aceites vegetales son todos triglicéridos, los cuales contienen una “cadena principal” de glicerol (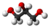 ) de tres carbonos con 3 “ácidos grasos” de cadena larga unidos a través de enlaces éster, como en la siguiente figura. La forma real se muestra en el modelo Jmol, que se puede girar con el ratón. Los triglicéridos se llaman “grasas” cuando son sólidos o semisólidos, y “aceites” cuando son líquidos.
) de tres carbonos con 3 “ácidos grasos” de cadena larga unidos a través de enlaces éster, como en la siguiente figura. La forma real se muestra en el modelo Jmol, que se puede girar con el ratón. Los triglicéridos se llaman “grasas” cuando son sólidos o semisólidos, y “aceites” cuando son líquidos.
|
Un triglicérido, insaturado en general, con la “cadena principal” de glicerol a la izquierda, y ácido palmítico saturado, ácido oleico monoinsaturado y ácido alfa-linolénico poliinsaturado. Los átomos de carbono están en cada curva de la estructura y se omiten los átomos de hidrógeno. |
Los ácidos grasos de cadena larga pueden estar saturados con átomos de hidrógeno, en cuyo caso tienen todos los enlaces simples como el ácido graso superior en la Figura (que es ácido palmítico). Si tienen menos átomos de hidrógeno, son insaturados y tienen dobles enlaces como el ácido graso medio en la Figura (que es ácido oleico). El ácido graso inferior es poliinsaturado, con múltiples dobles enlaces (es ácido linolénico). Varios aceites de cocina tienen |concentraciones conocidas de ácidos grasos saturados e insaturados.
Carbohidratos
Los carbohidratos están compuestos por unidades simples de azúcar. La molécula de sacarosa (azúcar de mesa ordinaria) que se muestra a continuación está compuesta por un “monosacáridos” de glucosa y fructosa.
|
Sacarosa, C 12 H 22 O 11 (los átomos de C están en cada curva, no se muestran los átomos de H) |
Una clave de por qué las grasas tienen más del doble del valor calórico de los azúcares proviene de las reacciones de combustión:
Una reacción típica de combustión de azúcar es
C 12 H 22 O 11 + 6 O 2 → 6 CO 2 + 6 H 2 O
Requiere 6 mol O 2 por cada 6 mol de C, una relación 1:1. Dado que la masa molar de sacarosa es de 180 g/mol, se requiere aproximadamente 0.033 mol O 2 por gramo.
Mientras que una combustión típica de grasa podría ser
C 56 H 108 O 6 + 80 O 2 → 56 CO 2 + 54 H 2 O
Requiere 80 mol O 2 por cada 56 mol de C, una relación de 1. 42:1. O bien, dado que la masa molar de la grasa mostrada es de 878 g/mol, se requiere aproximadamente 0.091 mol O 2 por gramo. La grasa requiere mucho más oxígeno para quemarse, y en consecuencia produce más energía. Vemos por qué al observar las proporciones molares C:O en grasas y azúcares:
En la grasa anterior,
\(\text{S}\left( \frac{\text{C}}{\text{O}} \right)=\frac{\text{56 mol C}}{\text{6 mol O}}\)(una relación 9. 3:1). O para el azúcar,
\(\text{S}\left( \frac{\text{C}}{\text{O}} \right)=\frac{\text{6 mol C}}{\text{6 mol O}}\) (una proporción 1:1).
Dado que el azúcar ya está más oxigenado, produce menos energía cuando se quema.
Al mirarlo de otra manera, el carbono, que reacciona con el oxígeno y libera energía en la combustión, es una parte más grande de la grasa:
En grasa:\(S\left( \frac{\text{C}}{\text{C}_{56}\text{H}_{108}\text{O}_{6}} \right)=\frac{\text{56 mol C}}{\text{1 mol C}_{56}\text{H}_{108}\text{O}_{6}}\) o 56 mol C/877.5 g C 56 H 108 O 6 = 0.064 mol C/g grasa.
En Azúcar:\(S\left( \frac{\text{C}}{\text{C}_{6}\text{H}_{12}\text{O}_{6}} \right)=\frac{\text{6 mol C}}{\text{1 mol C}_{6}\text{H}_{12}\text{O}_{6}}\) o 6 mol C/180 g C 6 H 12 O 6 = 0.033 mol C/g grasa.
Veremos a continuación que estas proporciones realmente nos permiten determinar la fórmula química para una grasa, azúcar o cualquier otro compuesto.
Las relaciones estequiométricas derivadas de fórmulas en lugar de ecuaciones están involucradas en el procedimiento más común para determinar las fórmulas empíricas de compuestos que contienen solo C, H y O. Una cantidad pesada de la sustancia a analizar se coloca en un tren de combustión y se calienta en una corriente de O seco 2. Todo el H en el compuesto se convierte en H 2 O (g) el cual es atrapado selectivamente en un tubo de absorción previamente pesado. Todo el C se convierte en CO 2 (g) y éste es absorbido selectivamente en un segundo tubo. El incremento de masa de cada tubo indica, respectivamente, cuánto H 2 O y CO 2 fueron producidos por la combustión de la muestra
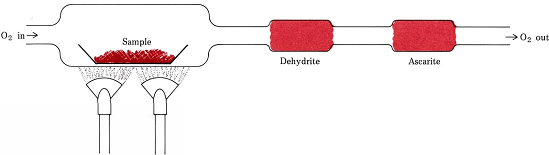
EJEMPLO 1 Una muestra de 1.000 g de una grasa se quemó en un tren de combustión, produciendo 2.784 g de CO 2 y 1.140 g de H 2 O. Determinar la fórmula empírica de la grasa.
Solución
Necesitamos saber la cantidad de C, la cantidad de H y la cantidad de O en la muestra. La relación de estos da los subíndices en la fórmula. Los dos primeros se pueden obtener de las masas de CO 2 y H 2 O usando las masas molares y las relaciones estequiométricas
\(\text{S}\left( \frac{\text{C}}{\text{CO}_{\text{2}}} \right)=\frac{\text{1 mol C}}{\text{1 mol CO}_{\text{2}}}\)\(\text{S}\left( \frac{\text{H}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{2 mol H}}{\text{1 mol H}_{\text{2}}\text{O}}\)Así
\(n_{\text{C}}=\text{2.784 g CO}_{\text{2}}\times \frac{\text{1 mol CO}_{\text{2}}}{\text{44}\text{.01 g CO}_{\text{2}}}\times \frac{\text{1 mol C}}{\text{1 mol CO}_{\text{2}}}=\text{0.06326 mol C}\)
\(n_{\text{H}}=\text{ 1.140 g H}_{\text{2}}\text{O}\times \frac{\text{1 mol H}_{\text{2}}\text{O}}{\text{18}\text{.02 g H}_{\text{2}}\text{O}}\times \frac{\text{2 mol H}}{\text{1 mol H}_{\text{2}}\text{O}}=\text{0.1265 mol H}\)El compuesto también puede haber contenido oxígeno. Para ver si lo hace, calcular las masas de C y H y restar de la masa total de la muestra
\ (\ begin {align} & m_ {\ text {C}} =\ text {0.06326 mol C}\ veces\ frac {\ texto {12}\ texto {.01 g C}} {\ texto {1 mol C}} =\ texto {0.7598 g C}\\ &\ m_ {\ texto {H}} =\ texto {0.1265 mol H}\ veces\ frac {\ texto {1}\ texto {.008 g H}} {\ texto {1 mol H}} =\ texto {0.1275g H}\ \ end {align}\)
Así tenemos 1.000 g de muestra — 0.7598 g C — 0.1275 g H = 0.1128 g O y\(n_{\text{O}}=\text{0.1128 g O}\times \frac{\text{1 mol O}}{\text{16}\text{.00 g O}}=\text{0.007050 mol O}\) Las proporciones de las cantidades de los elementos en el ácido ascórbico son por lo tanto\(\frac{n_{\text{H}}}{n_{\text{O}}}=\frac{\text{0.1265 mol H}}{\text{0.00705 mol C}}=\frac{\text{17.94 mol H}}{\text{1 mol O}}\)
\(\frac{n_{\text{C}}}{n_{\text{O}}}=\frac{\text{20.06326 mol O}}{\text{0.00705 mol O}}=\frac{\text{8.97 mol C}}{\text{1 mol C}}\)
Dado que n C: n H: n O es 9 mol C: 18 mol H: 1 mol O, la fórmula empírica es C 9 H 18 O 1.
Debido a que la mayoría de las grasas tienen 3 ácidos grasos unidos al glicerol con 2 átomos de oyxgen en cada enlace “éster”, la fórmula molecular es probablemente C 54 H 108 O 6. Esta molécula contendría la cadena principal de glicerol de 3 carbonos, las 3 cadenas de ácidos grasos compartirían los 51 átomos de carbono restantes, y serían de longitud promedio 51/3 = 17 átomos de carbono.
EJEMPLO 2 Una muestra de 6.49 mg de ácido ascórbico (vitamina C) se quemó en un tren de combustión. Se formaron 9.74 mg de CO 2 y 2.64 mg de H 2 O. Determinar la fórmula empírica del ácido ascórbico.
Solución
Necesitamos saber la cantidad de C, la cantidad de H y la cantidad de O en la muestra. La relación de estos da los subíndices en la fórmula. Los dos primeros se pueden obtener de las masas de CO 2 y H 2 O usando las masas molares y las relaciones estequiométricas
\(\text{S}\left( \frac{\text{C}}{\text{CO}_{\text{2}}} \right)=\frac{\text{1 mol C}}{\text{1 mol CO}_{\text{2}}}\)\(\text{S}\left( \frac{\text{H}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{2 mol H}}{\text{1 mol H}_{\text{2}}\text{O}}\)Así
\(n_{\text{C}}=\text{9}\text{.74}\times \text{10}^{\text{-3}}\text{g CO}_{\text{2}}\times \frac{\text{1 mol CO}_{\text{2}}}{\text{44}\text{.01 g CO}_{\text{2}}}\times \frac{\text{1 mol C}}{\text{1 mol CO}_{\text{2}}}=\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol C}\)
\(n_{\text{H}}=\text{2}\text{.64}\times \text{10}^{\text{-3}}\text{g H}_{\text{2}}\text{O}\times \frac{\text{1 mol H}_{\text{2}}\text{O}}{\text{18}\text{.02 g H}_{\text{2}}\text{O}}\times \frac{\text{2 mol H}}{\text{1 mol H}_{\text{2}}\text{O}}=\text{2}\text{.93}\times \text{10}^{\text{-4}}\text{ mol H}\)El compuesto también puede haber contenido oxígeno. Para ver si lo hace, calcular las masas de C y H y restar de la masa total de la muestra
\ (\ begin {align} & m_ {\ text {C}} =\ text {2}\ text {.21}\ times\ text {10} ^ {\ text {-4}}\ text {mol C}\ times\ frac {\ text {12}\ text {.01 g C}} {\ text {1 mol C}} =\ text {2}\ text {.65}\ veces\ texto {10} ^ {\ texto {-3}}\ texto {g C} =\ texto {2}\ texto {.65 mg C}\\ &\ & m_ {\ texto {C}} =\ texto {2}\ texto {.93}\ veces\ texto {10} ^ {\ texto {-4}}\ texto {mol H}\ veces\ frac {\ texto {1}\ texto {.008 g H}} {\ texto {1 mol H}} =\ texto {2}\ texto {.95}\ veces\ texto {10} ^ {\ texto {-4}}\ texto {g H} =\ texto {0}\ texto {.295 mg H}\ \ final {alinear}\)
Así tenemos 6.49 mg de muestra — 2.65 mg C — 0.295 mg H = 3.54 mg O y\(n_{\text{O}}=\text{3}\text{.54}\times \text{10}^{\text{-3}}\text{ g O}\times \frac{\text{1 mol O}}{\text{16}\text{.00 g O}}=\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol O}\) Las proporciones de las cantidades de los elementos en el ácido ascórbico son por lo tanto\(\frac{n_{\text{H}}}{n_{\text{C}}}=\frac{\text{2}\text{.93}\times \text{10}^{\text{-4}}\text{ mol H}}{\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol C}}=\frac{\text{1}\text{.33 mol H}}{\text{1 mol C}}=\frac{\text{1}\tfrac{1}{3}\text{mol H}}{\text{1 mol C}}=\frac{\text{4 mol H}}{\text{3 mol C}}\)
\(\frac{n_{\text{O}}}{n_{\text{C}}}=\frac{\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol O}}{\text{2}\text{.21}\times \text{10}^{\text{-4}}\text{ mol C}}=\frac{\text{1 mol O}}{\text{1 mol C}}=\frac{\text{3 mol O}}{\text{3 mol C}}\)
Dado que n C: n H: n O es 3 mol C:4 mol H:3 mol O, la fórmula empírica es C 3 H 4 O 3.
Aquí se muestra un dibujo de una molécula de ácido ascórbico. Se puede determinar contando los átomos que la fórmula molecular es C 6 H 8 O 6 —exactamente el doble de la fórmula empírica. También es evidente que hay más que saber sobre una molécula que solo cuántos átomos de cada tipo están presentes. En el ácido ascórbico, como en otras moléculas, la forma en que los átomos están conectados entre sí y su disposición en el espacio tridimensional son bastante importantes. Una imagen que muestra qué átomos están conectados a los cuales se llama fórmula estructural. Las fórmulas empíricas pueden obtenerse a partir de experimentos de porcentaje de composición o tren de combustión y, si se conoce el peso molecular, las fórmulas moleculares pueden determinarse a partir de los mismos datos. Se requieren experimentos más complicados para encontrar fórmulas estructurales. En el Ejemplo 2 se obtuvo la masa de O restando las masas de C y H de la masa total de la muestra. Esto suponía que solo estaban presentes C, H y O. En ocasiones tal suposición puede ser incorrecta. Cuando la penicilina se aisló y analizó por primera vez, se omitió el hecho de que contenía azufre. Este error no fue descubierto desde hace algún tiempo porque el peso atómico del azufre es casi exactamente el doble que el del oxígeno. Se sustituyeron dos átomos de oxígeno en lugar de un átomo de azufre en la fórmula.
Una representación 3D del ácido L-ascórbico <chemeddl-jmol2>ascorbico|tamaño=300</chemeddl-jmol2>
Referencias
- ↑ Wolke, R.L. “Lo que Einstein le dijo a su cocinero”, W.W. Norton & Co., NY, 2002, p.65