3.10.3: Geología- Cálculo del Calor Liberado por Serpentinización en la “Ciudad Perdida”
- Page ID
- 75929
Anteriormente, se introdujo la Serpentinización, los procesos geotérmicos que calientan el agua hasta 91°C (196°F) en los respiraderos geotérmicos del Macizo Atlántico [1]. Un “video Fly-in” pone la formación en perspectiva.
|
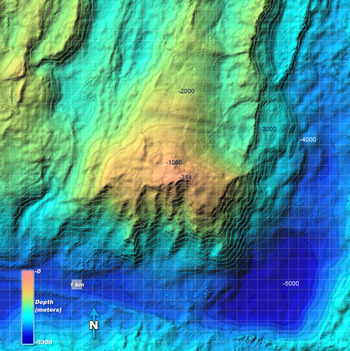
El Macizo de la Atlántida se eleva ~14,000 pies sobre el fondo marino circundante y está formado por fallas de larga duración [2] |
La brida 'IMAX' de ventilación activa sobresale del costado de la estructura masiva de Poseidón, fotografiada por el sumergible Hércules [3]. |
Cálculo del calor liberado por la serpentinización
Por ahora los químicos han medido los cambios de entalpía para tantas reacciones que se necesitarían varios volúmenes grandes para enumerar todas las ecuaciones termoquímicas. Ahora veremos cómo se puede calcular fácilmente la entalpía de la reacción de serpentinización, y muchas variaciones sobre ella que tal vez nunca se tabulen.

Por ejemplo, si nos interesa una de las principales reacciones de serpentinización que proporciona calor a los respiraderos térmicos:
Forsterita + sílice acuosa → serpentina (crisotilo)
3 Mg 2 SiO 4 (s) + SiO 2 (aq) + 4 H 2 O (l) → 2 Mg 3 Si 2 O 5 (s) (OH) 4 (s) (1)
Podemos usar la ley de Hess' para calcular el Δ H m a partir de una sola lista de entalpías estándar de formación Δ H f, para todos los compuestos. La entalpía estándar de formación es el cambio de entalpía cuando se forma 1 mol de una sustancia pura a partir de sus elementos. Cada elemento debe estar en la forma física y química que sea más estable a presión atmosférica normal y a una temperatura especificada (generalmente 25°C).
Por ejemplo, si sabemos que Δ H f [H 2 O (l)] = —285.8 kJ mol —1, podemos escribir inmediatamente la ecuación termoquímica
H 2 (g) + ½O 2 (g) → H 2 O (l) Δ H m = —285.8 kJ mol —1 (2) Los elementos H y O aparecen como moléculas diatómicas y en forma gaseosa debido a que estos son sus estados químicos y físicos más estables. Obsérvese también que se desprenden 285.8 kJ por mol de H 2 O (l) formado. La ecuación (1) debe especificar la formación de 1 mol H 2 O (l), por lo que el coeficiente de O 2 debe ser ½.
Ejemplo 1
Calcular el cambio de entalpía para la Ecuación (1) a partir de los calores de formación de los reactivos y productos.
| 3 Mg 2 SiO 4 | + SiO 2 (aq) | + 4 H 2 O → | 2 Mg 3 Si 2 O 5 (OH) 4 | |
|---|---|---|---|---|
| ΔH f kJ*mol -1* |
-2173.6 | -876.9 | -285.8 | -4360.3 |
* valores de SUPCRT [5]
Solución
Podemos imaginar que la reacción se lleva a cabo en cuatro etapas, cada una de las cuales implica sólo una entalpía estándar de formación. Primero, los reactivos se descompondrán en sus elementos, luego los elementos se recombinarán en el producto.
En el primer paso H 2 O (l) (agua) se descompone a sus elementos:
4H 2 O (l) → 2 O 2 (g) + 4H 2 (g) Δ H 3 = (3)
Dado que este es el reverso de la formación de 4 mol H 2 O (l) a partir de sus elementos, el cambio de entalpía es
Δ H 3 = 4 mol × {—Δ H f [H 2 O (l)]} = 4 mol × [— (—285.8 kJ mol —1)] = +1143.2 kJ
En el segundo paso el SiO 2 (s) se descompone de manera similar en sus elementos, con un cambio de entalpía igual al negativo de su calor de formación:
SiO 2 (s) → Si (s) + O 2 (g) Δ H 4 (4)
Δ H 4 = 1 mol × - Δ H f [SiO 2 (g)] = 1 mol × - (— 876.9 kJ mol —1) = + 876.9 kJ
El reactivo final, 2 Mg 2 SiO 4 se descompone en elementos de la siguiente manera, y el cambio de entalpía será el doble del negativo Δ H m
3 Mg 2 SiO 4 → 6 O 2 + 6 Mg (s) + 2 Si (s) Δ H 5 (5)
Δ H 5 = 3 mol × {—Δ H f [Mg 2 SiO 4]} = 3 mol × [— (—2173.6 kJ mol —1)] = +6520.8 kJ
Finalmente, escribimos la reacción para la formación del producto a partir de elementos:
6 Mg (s) + 4 Si (s) + 9 O 2 + 2 H 2 O → 2 Mg 3 Si 2 O 5 (OH) 4 (s) Δ H 6 (6)
Δ H m = 2 mol × {Δ H f [Mg 3 Si 2 O 5 (OH) 4]} = 2 mol × [(—4360.3 kJ mol —1)] = -8720.6 kJ Se puede verificar fácilmente que la suma de las Ecuaciones (3) - (6) es la Ecuación (1).
Por lo tanto
Δ H neto = Δ H 3 + Δ H 4 + Δ H 5 + Δ H 6
= +1143.2 kJ + 876.9 kJ +6520.8 kJ -8720.6 kJ = — 179.7 kJ mol
Anote cuidadosamente cómo se resolvió el Ejemplo 1. Los compuestos reactivos Mg 2 SiO 4 (s) SiO 2 (s) y H 2 O (l) se descompusieron hipotéticamente en sus elementos. Estas ecuaciones fueron el reverso de la formación de los compuestos, por lo que Δ H 1 fue de signo opuesto a Δ H f. El paso 1 también involucró 4 mol H 2 O (s) y así el cambio de entalpía tuvo que multiplicarse por 4.
En la etapa 2, tuvimos la descomposición hipotética de SiO 2 (s), con un cambio de entalpía que es el negativo de Δ H f; finalmente, la descomposición hipotética de 3 mol de Mg 2 SiO 4 aportando 3 x -Δ H f, y finalmente, tuvimos la formación hipotética del producto Mg 3 Si 2 O 5 (OH) 4 (s) a partir de sus elementos. A partir de que se obtuvieron 2 mol, el cambio de entalpía se duplicó pero su signo se mantuvo igual.
Cualquier reacción química puede abordarse de manera similar. Para calcular Δ H m sumamos todos los valores Δ H f para los productos, multiplicando cada uno por el coeficiente apropiado, como en el paso 2 anterior. Dado que los signos de Δ H f para los reactivos tuvieron que ser revertidos en el paso 1, los restamos, multiplicando nuevamente por coeficientes apropiados. Esto puede resumirlo por la ecuación
Δ H m = Δ H f (productos) — Δ H f (reactivos) (7) El símbolo σ significa “la suma de.” Dado que los valores de Δ H f se dan por mol de compuesto, debe estar seguro de multiplicar cada Δ H f por un coeficiente apropiado derivado de la ecuación para la que se está calculando Δ H m.
Aplicando esta ecuación al Ejemplo que acabamos de completar,
Δ H m = [2 mol x -4360.6 kJ/mol] - [3 mol x 2173.6 kJ/mol) + (1 mol x -876.9 kJ/mol) + (4 mol x -285.8 kJ/mol)] = -179.7 kJ.
Este es el cambio de entalpía para la reacción tal como está escrito, formando 2 mol de producto.
Calores de formación que no se pueden medir
En algunos casos, como el del agua, los elementos reaccionarán directamente para formar un compuesto, y la medición del calor absorbido sirve para determinar Δ H f. Muy a menudo, sin embargo, los elementos no reaccionan directamente entre sí para formar el compuesto deseado, y Δ H f debe calcularse combinando los cambios de entalpía para otras reacciones. En el caso de la “sílice acuosa”, SiO 2 (aq), la especie no se forma realmente a partir de Si y O 2, sin embargo, su entalpía de formación puede calcularse a partir de otros cambios conocidos de entalpía, y usarse legítimamente siempre que la especie esté especificada y bien definida.
Cuando los silicatos se disuelven, forman H 4 SiO 4 (ácido silícico, a veces escrito Si (OH) 4). Conocemos el calor de formación de estas soluciones de sílice:
- Si (s) + O 2 (g) + 2 H 2 (g) + O 2 (g) → Si (OH) 4 (qtz) (l) Δ H m = -1457.3 kJ mol —1 [6] [7] (1)
Y sabemos el cambio de entalpía para la reacción
- 2 H 2 O (l) → 2 H 2 (g) + O 2 (g) Δ H m = 571.6 kJ mol —1 (2)
Entonces combinando los dos, y viendo Si (OH) 4 (aq) como SiO 2 (aq) •2 H 2 O, obtenemos un calor válido de formación para:
- Si (s) + O 2 (g) → SiO 2 (aq) (l) Δ H m = -885.7 kJ mol —1 (8)
para la especie ficticia SiO 2 (aq) (SiO 2 disuelto sin enlaces Si-O-H), y podemos reemplazar SiO 2 (qtz) + 2 H 2 O (l) (Δ H f = -910.9 + 571.6 = 1457.3 kJ) con SiO 2 (aq) (Δ H f = -885.7 kJ) en ecuaciones geotérmicas. En otras palabras, podríamos haber escrito la Ecuación (1) como
3 Mg 2 SiO 4 (s) + Si (OH) 4 (aq) + 2 H 2 O (l) → 2 Mg 3 Si 2 O 5 (OH) 4 {s) Δ H m = -179.7 kJ mol —1 [8] (25°C, 1 atm de presión) (1b)
Entalpía Estándar de Formación de Elementos
Otro punto surge de la definición de Δ H f. La entalpía estándar de formación para un elemento en su estado más estable debe ser cero. Si formamos oxígeno a partir de sus elementos, por ejemplo, estamos hablando de la reacción
O 2 (g) → O 2 (g) Dado que el oxígeno no ha cambiado, no puede haber cambio de entalpía, y Δ H f = 0 kJ mol —1.
Tablas de entalpías estándar de formación
Existen muchas fuentes de entalpías estándar de formación para especies geológicamente importantes. Un artículo de Wikipedia tiene referencias a varios de ellos. Varias compilaciones impresas están disponibles, incluyendo las citadas en este ejemplo [9]
Muchos incluyen software que ajusta los valores a las altas presiones (cientos de bares (o atmósferas) y temperaturas requeridas por los geólogos. Por ejemplo, FREED o THERBAL o SUPCRT92 [10].
Las entalpías estándar de formación para algunos compuestos comunes se dan en la siguiente tabla. Estos valores pueden ser utilizados para calcular Δ H m para cualquier reacción química siempre y cuando todos los compuestos involucrados aparezcan en las tablas. Para ver cómo y por qué se puede hacer esto, considere el siguiente ejemplo.
Algunas entalpías estándar de formación a 25°C.
| Compuesto |
Δ H f /kJ mol —1 |
Δ H f /kcal mol —1 |
Compuesto |
Δ H f /kJ mol —1 |
Δ H f /kcal mol —1 |
|---|---|---|---|---|---|
| AgCl (s) | —127.068 | —30.35 | H 2 O (g) | —241.818 | —57.79 |
| AgN 3 (s) | +620.6 | +148.3 | H 2 O (l) | —285.8 | —68.3 |
| Ag 2 O (s) | —31.0 | —7.41 | H 2 O 2 (l) | —187.78 | —44.86 |
| Al 2 O 3 (s) | —1675.7 | —400.40 | H 2 S (g) | —20.63 | —4.93 |
| Br 2 (l) | 0.0 | 0.00 | HgO (s) | —90.83 | —21.70 |
| Br 2 (g) | +30.907 | +7.385 | I 2 (s) | 0.0 | 0.0 |
| C (s), grafito | 0.0 | 0.00 | I 2 (g) | +62.438 | +14.92 |
| C (s), diamante | +1.895 | +0.453 | KCl (s) | —436.747 | —104.36 |
| CH 4 (g) | —74.81 | —17.88 | KBr (s) | —393.798 | —94.097 |
| CO (g) | —110.525 | —26.41 | MgO (s) | —601.7 | —143.77 |
| CO 2 (g) | —393.509 | —94.05 | NH 3 (g) | —46.11 | —11.02 |
| C 2 H 2 (g) | +226.73 | +54.18 | NO (g) | +90.25 | +21.57 |
| C 2 H 4 (g) | +52.26 | +12.49 | NO 2 (g) | +33.18 | +7.93 |
| C 2 H 6 (g) | —84.68 | —20.23 | N 2 O 4 (g) | +9.16 | +2.19 |
| C 6 H 6 (l) | +49.03 | +11.72 | NF 3 (g) | —124.7 | —29.80 |
| CaO (s) | —635.09 | —151.75 | NaBr (s) | —361.062 | —86.28 |
| CaCo 3 (s) | —1206.92 | —288.39 | NaCl (s) | —411.153 | —98.24 |
| CuO (s) | —157.3 | —37.59 | O 3 (g) | +142.7 | +34.11 |
| Fe 2 O 3 (s) | —824.2 | —196.9 | SO 2 (g) | —296.83 | —70.93 |
| HBr (g) | —36.4 | —8.70 | SO 3 (g) | —395.72 | —94.56 |
| HCl (g) | —92.307 | —22.06 | ZnO (s) | —348.28 | —83.22 |
| HI (g) | +26.48 | +6.33 |
Ejemplo 2
Utilice la tabla de entalpías estándar de formación a 25°C a continuación para calcular Δ H m para la reacción
Forsterita + agua → serpentina (crisotilo) + brucita
3 Mg 2 SiO 4 (s) +3 H 2 O (l) → 2 Mg 3 Si 2 O 5 (OH) 4 (s) + Mg (OH) 2 (s) Δ H m =? (25°C, 1 atm de presión) (3)
| 3 Mg 2 SiO 4 (s) | + 3 H 2 O (l) → | 2 Mg 3 Si 2 O 5 (OH) 4 (s) | + Mg (OH) 2 (s) | |
|---|---|---|---|---|
| ΔH f kJ mol -1 * |
-2173.6 | -285.5 | -4360.3 | -924.20 |
- valores de SUPCRT [11]
Solución
Usando la Eq. (4), tenemos
Δ H m = Δ H f (productos) — Δ H f (reactivos)
-
- = [1 mol x Δ H f (Mg (OH) 2) + 2mol x Δ H f (Mg 3 Si 2 O 5 (OH) 4)] — [3 mol x Δ H f (H 2 O) + 3 mol x Δ H f (Mg 2 SiO 4)]
-
- = 1 mol (—924.20) kJ mol —1 + 2 mol (-4360.3) kJ mol —1 — 3 (—285.8 kJ mol —1) — 3 mol × -2173.6 kJ mol —1
-
- = —924.20 kJ -8720.6 kJ + 856.5 kJ + 6520.8 kJ
-
- = -2267 kJ
Reacciones como esta abastecen las grandes cantidades de calor necesarias para impulsar los respiraderos térmicos de la “Ciudad Perdida”.
Ejemplo 3
Usar la tabla de entalpías estándar de formación a 25°C para calcular Δ H m para la reacción
4NH 3 (g) + 5O 2 (g) → 6H 2 O (g) + 4NO (g)
Solución Usando la Eq. (4), tenemos
Δ H m = Δ H f (productos) — Δ H f (reactivos)
= [6 Δ H f (H 2 O) + 4 Δ H f (NO)] — [4 Δ H f (NH 3) + 5 Δ H f (O 2)]
= 6 (—241.8) kJ mol —1 + 4 (90.3) kJ mol —1 — 4 (—46,1 kJ mol —1) — 5 × 0
= —1450.8 kJ mol —1 + 361.2 kJ mol —1 + 184.4 kJ mol —1
= —905.2 kJ mol —1
Tenga en cuenta que tuvimos cuidado de usar Δ H f [H 2 O (g)] no Δ H f [H 2 O (l)]. Aunque el vapor de agua no es la forma más estable de agua a 25°C, todavía podemos usar su valor Δ H f. También la entalpía estándar de formación del elemento O 2 (g) es cero por definición. Obviamente sería un desperdicio de espacio incluirlo en la tabla anterior.
Referencias
- ↑ Ciudad Perdida [es.wikipedia.org]
- ↑ Geología [www.lostcity.washington.edu]
- ↑ www.lostcity.washington.edu/file/imax+
- ↑ www.lostcity.washington.edu/f... +Cort+3863-1419
- ↑ GEOPIG Reactivos de Aplicación Supcrt [geopig3.la.asu.edu:8080]
- ↑ Nordstrom, D.K.; Muñoz, J.L. “Termodinámica Geoquímica”, 2a Ed., Blackwell Scientific Publishers, Boston,1994, p. 442
- ↑ Nordstrom, D.K.; Plummer, L.N.; Langmuir, D., et al. “Se revisaron los datos de equilibrio químico para las principales reacciones agua-minerales y sus limitaciones”. En Massett químico, pp. 398-413. Simposio de la Sociedad Americana de Química Serie 416.
- ↑ valores de SUPCRT. Reactivos de Aplicación GEOPIG Supcrt [geopig3.la.asu.edu:8080]
- ↑ Robie, R. A.; Hemingway, B.S. “Propiedades Termodinámicas de Minerales y Sustancias Relacionadas a 298.15 K y 1 Bar (10 5 Pascales) de Presión y a Temperaturas Superiores”. Boletín de Servicio Geológico de Estados Unidos 2131, Oficina de Imprenta del Gobierno de Estados Unidos, Washington, DC: 1995.
- ↑ GEOPIG Reactivos de Aplicación Supcrt [geopig3.la.asu.edu:8080]
- ↑ GEOPIG Reactivos de Aplicación Supcrt [geopig3.la.asu.edu:8080]



