3.10: Entalpías Estándar de Formación
- Page ID
- 75904
Por ahora los químicos han medido los cambios de entalpía para tantas reacciones que se necesitarían varios volúmenes grandes para enumerar todas las ecuaciones termoquímicas. Afortunadamente la ley de Hess' permite enumerar un solo valor, la entalpía estándar de formación Δ H f, para cada compuesto. La entalpía estándar de formación es el cambio de entalpía cuando se forma 1 mol de una sustancia pura a partir de sus elementos. Cada elemento debe estar en la forma física y química que sea más estable a presión atmosférica normal y a una temperatura especificada (generalmente 25°C).
Por ejemplo, si lo sabemos\[ \Delta H_{f} [ \text{H}_{2} \text{O} (l) ] = –285.8 \text{ kJ } \text{mol}^{-1} \nonumber \], podemos escribir inmediatamente la ecuación termoquímica
\[ \text{H}_{2} (g) + \frac{1}{2} \text{O}_{2} (g) \rightarrow \text{H}_{2} \text{O} (l) ~~~~~~~~~~~~ \Delta H_{m} = –285.8 \text{ kJ} \text{mol}^{-1} \label{1} \]
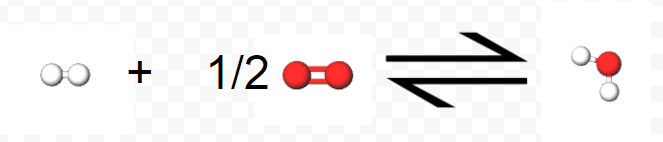

Los elementos H y O aparecen como moléculas diatómicas y en forma gaseosa porque estos son sus estados químicos y físicos más estables. Obsérvese también que se desprenden 285.8 kJ por mol de H 2 O (l) formado. La ecuación\(\ref{1}\) debe especificar la formación de 1 mol H 2 O (l), por lo que el coeficiente de O 2 debe ser ½. Tenga en cuenta las 3 vistas diferentes de esta reacción, la ecuación que proporciona una vista simbólica, las moléculas 3D que proporcionan una vista microscópica, y las fotos que proporcionan una vista macroscópica de la reacción como la veríamos con nuestros propios 2 ojos.
En algunos casos, como el del agua, los elementos reaccionarán directamente para formar un compuesto, y la medición del calor absorbido sirve para determinar Δ H f. Muy a menudo, sin embargo, los elementos no reaccionan directamente entre sí para formar el compuesto deseado, y Δ H f debe calcularse combinando los cambios de entalpía para otras reacciones. Un caso en punto es el gas acetileno, C 2 H 2. En el Ejemplo 1 de la sección Ley de Hess' mostramos que la ecuación termoquímica
\[2 \text{C} (s) + \text{H}_{2} (g) \rightarrow \text{C}_{2} \text{H}_{2} (g) ~~~~~~~~~ \Delta H_{m} = 227.0 \text{ kJ } \text{mol}^{-1} \nonumber \]
era válido. Ya que involucra 1 mol C 2 H 2 y los elementos están en sus formas más estables, podemos decir que Δ H f [C 2 H 2 (g)] = 227.0 kJ mol —1.
Otro punto surge de la definición de Δ H f. La entalpía estándar de formación para un elemento en su estado más estable debe ser cero. Si formamos mercurio a partir de sus elementos, por ejemplo, estamos hablando de la reacción
\[ \text{Hg} (l) \rightarrow \text{Hg} (l) \nonumber \]
Dado que el mercurio no ha cambiado, no puede haber ningún cambio de entalpía, y\[ \Delta H_{f} = 0 \text{ kJ} \text{ mol}^{-1} \nonumber \].
| Compuesto |
Δ H f /kJ mol —1 |
Δ H f /kcal mol —1 |
Compuesto |
Δ H f /kJ mol —1 |
Δ H f /kcal mol —1 |
|---|---|---|---|---|---|
| AgCl (s) |
—127.068
|
—30.35
|
H 2 O (g) |
—241.818
|
—57.79
|
| AgN 3 (s) |
+620.6
|
+148.3
|
H 2 O (l) |
—285.8
|
—68.3
|
| Ag 2 O (s) |
—31.0
|
—7.41
|
H 2 O 2 (l) |
—187.78
|
—44.86
|
| Al 2 O 3 (s) |
—1675.7
|
—400.40
|
H 2 S (g) |
—20.63
|
—4.93
|
| Br 2 (l) |
0.0
|
0.00
|
HgO (s) |
—90.83
|
—21.70
|
| Br 2 (g) |
+30.907
|
+7.385
|
I 2 (s) |
0.0
|
0.0
|
| C (s), grafito |
0.0
|
0.00
|
I 2 (g) |
+62.438
|
+14.92
|
| C (s), diamante |
+1.895
|
+0.453
|
KCl (s) |
—436.747
|
—104.36
|
| CH 4 (g) |
—74.81
|
—17.88
|
KBr (s) |
—393.798
|
—94.097
|
| CO (g) |
—110.525
|
—26.41
|
MgO (s) |
—601.7
|
—143.77
|
| CO 2 (g) |
—393.509
|
—94.05
|
NH 3 (g) |
—46.11
|
—11.02
|
| C 2 H 2 (g) |
+226.73
|
+54.18
|
NO (g) |
+90.25
|
+21.57
|
| C 2 H 4 (g) |
+52.26
|
+12.49
|
NO 2 (g) |
+33.18
|
+7.93
|
| C 2 H 6 (g) |
—84.68
|
—20.23
|
N 2 O 4 (g) |
+9.16
|
+2.19
|
| C 6 H 6 (l) |
+49.03
|
+11.72
|
NF 3 (g) |
—124.7
|
—29.80
|
| CaO (s) |
—635.09
|
—151.75
|
NaBr (s) |
—361.062
|
—86.28
|
| CaCo 3 (s) |
—1206.92
|
—288.39
|
NaCl (s) |
—411.153
|
—98.24
|
| CuO (s) |
—157.3
|
—37.59
|
O 3 (g) |
+142.7
|
+34.11
|
| Fe 2 O 3 (s) |
—824.2
|
—196.9
|
SO 2 (g) |
—296.83
|
—70.93
|
| HBr (g) |
—36.4
|
—8.70
|
SO 3 (g) |
—395.72
|
—94.56
|
| HCl (g) |
—92.307
|
—22.06
|
ZnO (s) |
—348.28
|
—83.22
|
| HI (g) |
+26.48
|
+6.33
|
Las entalpías estándar de formación para algunos compuestos comunes se dan en la Tabla\(\PageIndex{1}\). Estos valores pueden ser utilizados para calcular Δ H m para cualquier reacción química siempre y cuando todos los compuestos involucrados aparezcan en las tablas. Para ver cómo y por qué se puede hacer esto, considere el siguiente ejemplo.
Usar entalpías estándar de formación para calcular Δ H m para la reacción
\[ 2 \text{CO} (g) + \text{O}_{2} (g) \rightarrow 2 \text{C} \text{O}_{2} (g) \nonumber \]
Solución:
Podemos imaginar que la reacción se lleva a cabo en dos etapas, cada una de las cuales implica sólo una entalpía estándar de formación. En el primer paso el CO (monóxido de carbono) se descompone a sus elementos:
\[ 2 \text{CO} (g) \rightarrow 2 \text{C} (s) + \text{O}_{2} (g) ~~~~~~~~~~ \Delta H_{m} = \Delta H_{1}\label{2} \]
Dado que este es el reverso de la formación de 2 moles de CO a partir de sus elementos, el cambio de entalpía es
\[ \Delta H_{1} = 2 \times { – \Delta H_{f} [ \text{CO} (g) ] } = 2 \times [ – ( – 110.5 \text{ kJ} \text{ mol}^{-1} ) ] = +221.0 \text{ kJ} \text{ mol}^{-1} \nonumber \]
En la segunda etapa los elementos se combinan para dar 2 mol de CO 2 (dióxido de carbono):
\[ 2 \text{C} (s) + 2 \text{O}_{2} (g) \rightarrow 2 \text{C} \text{O}_{2} (g) ~~~~~~~~~ \Delta H_{m} = \Delta H_{2} \label{3} \]
En este caso
\[ \Delta H_{2} = 2 \times \Delta H_{f} [ \text{C} \text{O}_{2} (g)] = 2 \times (– 393.5 \text{ kJ } \text{mol}^{-1}) = – 787.0 \text{ kJ } \text{mol}^{-1} \nonumber \]
Se puede verificar fácilmente que la suma de Ecuaciones\(\ref{2}\) y\(\ref{3}\) es
\[ 2 \text{CO} (g) + 2 \text{O}_{2} (g) \rightarrow 2 \text{C} \text{O}_{2} (g) ~~~~~~~~~~~ \Delta H_{m} = \Delta H_{net} \nonumber \]
Por lo tanto
\[ \Delta H_{net} = \Delta H_{1} + \Delta H_{2} = 221.0 \text{ kJ } \text{mol}^{-1} – 787.0 \text{mol}^{-1} = – 566.0 \text{mol}^{-1} \nonumber \]
Anote cuidadosamente cómo\(\PageIndex{1}\) se resolvió el Ejemplo. En la etapa 1 el compuesto reactivo CO (g) se descompuso hipotéticamente en sus elementos. Esta ecuación fue la inversa de formación del compuesto, por lo que Δ H 1 fue de signo opuesto a Δ H f. El paso 1 también involucró 2 mol de CO (g) y así se tuvo que duplicar el cambio de entalpía. En el paso 2 tuvimos la formación hipotética del producto CO 2 (g) a partir de sus elementos. A partir de que se obtuvieron 2 mol, el cambio de entalpía se duplicó pero su signo se mantuvo igual.
Cualquier reacción química puede abordarse de manera similar. Para calcular Δ H m sumamos todos los valores Δ H f para los productos, multiplicando cada uno por el coeficiente apropiado, como en el paso 2 anterior. Dado que los signos de Δ H f para los reactivos tuvieron que ser revertidos en el paso 1, los restamos, multiplicando nuevamente por coeficientes apropiados. Esto puede resumirlo por la ecuación
\[ \Delta H_{m} = \sum \Delta H_{f} \text{ (products)} – \sum \Delta H_{f} \text{ (reactants)} \label{4} \]
El símbolo σ significa “la suma de”. Dado que los valores de Δ H f se dan por mol de compuesto, debe estar seguro de multiplicar cada Δ H f por un coeficiente apropiado derivado de la ecuación para la que se está calculando Δ H m.
Usar la tabla de entalpías estándar de formación a 25°C para calcular Δ H m para la reacción
\[ 4 \text{N} \text{H}_{3} (g) + 5 \text{O}_{2} (g) \rightarrow 6 \text{H}_{2} \text{O} (g) + 4 \text{NO} (g) \nonumber \]
Solución
Usando la ecuación\(\ref{4}\), tenemos
\[ \begin{align} \Delta H_{m} & = \sum \Delta H_{f} \text{ (products)} – \sum \Delta H_{f} \text{ (reactants)} \\ & = [ 6 \Delta H_{f} ( \text{H}_{2} \text{O} ) + 4 \Delta H_{f} \text{(NO)]} – [4 \Delta H_{f} \text{ (N} \text{H}_{3} ) + 5 \Delta H_{f} \text{ (O}_{2} )] \\ & = 6 ( – 241.8) \text{ kJ} \text{ mol}^{-1} + 4 ( 90.3 ) \text{ kJ} \text{ mol}^{-1} – 4(–46.1 \text{ kJ} \text{ mol}^{-1} ) – 5 \times 0 \\ & = –1450.8 \text{ kJ} \text{ mol}^{-1} + 361.2 \text{ kJ} \text{ mol}^{-1} + 184.4 \text{ kJ} \text{ mol}^{-1} \\ & = –905.2 \text{ kJ} \text{ mol}^{-1} \end{align} \nonumber \]
Tenga en cuenta que tuvimos cuidado de usar Δ H f [H 2 O (g)] no Δ H f [H 2 O (l)]. Aunque el vapor de agua no es la forma más estable de agua a 25°C, todavía podemos usar su valor Δ H f. También la entalpía estándar de formación del elemento O 2 (g) es cero por definición. Obviamente sería un desperdicio de espacio incluirlo en la tabla anterior.


