3.11.1: Biología- Concentraciones de Solución y Células
- Page ID
- 76065
La concentración de la solución juega un papel crítico en biología:
-
- Diferentes concentraciones de iones de hidrógeno en lados opuestos de una membrana proporcionan la fuerza impulsora para la síntesis de ATP, como lo demuestra una animación.
- La conducción nerviosa depende de gradientes de concentración de iones Na + y K + dentro y fuera de la célula nerviosa.
- La ósmosis, causada por diferentes concentraciones de solución dentro y fuera de las células, puede ser fatal tanto para las plantas como para los animales. Poner una planta en agua salada provoca marchitamiento y plasmólisis en las plantas (ver Figura), porque el agua se difunde fuera de las células. Los peces de agua dulce mueren rápidamente en agua salada por la misma razón. Si los líquidos intravenosos administrados en cirugía no son isotónicos (tener la misma concentración “osmolar” que el plasma y los glóbulos rojos pueden ser destruidos. Si la solución I.V. es hipertónica (concentración demasiado alta), los glóbulos rojos se deforman por crenación; si la I.V. es hipotónica (concentración demasiado baja, los glóbulos rojos estallan por “citólisis, como se muestra a continuación.
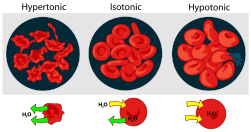
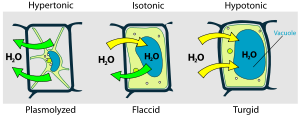
En el laboratorio, en tu cuerpo, y en el ambiente exterior, la mayoría de las reacciones químicas tienen lugar en soluciones. Macroscópicamente una solución se define como una mezcla homogénea de dos o más sustancias, es decir, una mezcla que parece ser uniforme en todas partes. En la escala microscópica una solución implica la disposición aleatoria de un tipo de átomo o molécula con respecto a otro.
Hay una serie de razones por las que las soluciones se encuentran tan a menudo tanto en la naturaleza como en el laboratorio. El tipo de solución más común consiste en un disolvente líquido que disuelve un soluto sólido. (El término disolvente suele referirse a la sustancia presente en mayor cantidad. Puede haber más de un soluto disuelto en él.) Debido a que un líquido adopta la forma de su contenedor pero no se expande para llenar todo el espacio disponible para él, las soluciones líquidas son convenientes de manejar. Puede verterlos fácilmente de un recipiente a otro, y sus volúmenes se miden fácilmente usando cilindros graduados, pipetas, burets, matraces volumétricos u otra cristalería de laboratorio. Además, los átomos o moléculas de sólidos disueltos en un líquido están muy juntos pero aún pueden pasar unos de otros. Se ponen en contacto entre sí con mayor frecuencia que si se colocaran dos sólidos uno al lado del otro. Esta “intimidad” en las soluciones líquidas a menudo facilita las reacciones químicas.
Dado que las soluciones ofrecen un medio conveniente para llevar a cabo reacciones químicas, a menudo es necesario saber cuánto de una solución reaccionará con una cantidad dada de otra. Ejemplos en otras secciones han demostrado que la cantidad de sustancia es la cantidad que determina cuánto de un material reaccionará con otro. La facilidad con que se pueden medir los volúmenes de solución sugiere que sería muy conveniente conocer la cantidad de sustancia disuelta por unidad de volumen de solución. Entonces al medir cierto volumen de solución, también estaríamos midiendo cierta cantidad de sustancia.
La concentración c de una sustancia en una solución (a menudo llamada molaridad) es la cantidad de la sustancia por unidad de volumen de solución:
\[\text{Concentration of solute, M}=\frac{\text{amount of solute, mol}}{\text{volume of solution, L}} \nonumber \]
\[c_{\text{solute, M}}~=~\frac{n_{\text{solute, mol}}}{V_{\text{solution,L}}} \label{2} \]
Por lo general, las unidades moles por decímetro cúbico (mol dm —3) o moles por litro (mol litro —1) se utilizan para expresar la concentración.
Si una sustancia pura es soluble en agua, es fácil preparar una solución de concentración conocida. Se pesa con precisión un recipiente con una muestra de la sustancia, y se vierte una masa apropiada de muestra a través de un embudo en un matraz aforado, como se muestra en la Figura 3.3. Luego se vuelve a pesar el contenedor. Cualquier sólido que se adhiera al embudo se enjuaga en el matraz, y se agrega agua hasta que el matraz esté aproximadamente tres cuartos lleno. Después de remolinar el matraz para disolver el sólido, se agrega agua cuidadosamente hasta que el fondo del menisco coincide con la marca de calibración en el cuello del flash.
|
La solución salina isotónica para aplicaciones médicas se elabora de acuerdo con el método anterior. El recipiente y el cloruro de sodio pesan 43.2874 g y la masa final después del vertido fue de 41.0374 g, el matraz tiene un volumen de 250 mL.
Solución
La concentración se puede calcular dividiendo la cantidad de soluto por el volumen de solución [Eq. (1)]:
-
- \(c_{\text{NaCl}}=\frac{n_{\text{NaCl}}}{V}\)
n NaCl = 2.2500 g ×\(\frac{\text{1 mol}}{\text{58}\text{.44 g}}\) = 3.850 × 10 -2 mol
El volumen de solución es de 250.00 ml, o solución V = 250.00 cm 3 ×\(\frac{\text{1 dm}^{\text{3}}}{\text{10}^{\text{3}}\text{ cm}^{\text{3}}}\) = 2.5000 × 10 -1 dm 3 o .250 L Así\(c_{\text{NaCl}}=\frac{n_{\text{NaCl}}}{V_{\text{solution}}}=\frac{\text{3}\text{.850}\times \text{10}^{\text{-2}}\text{ mol }}{\text{250}\text{.00 }\times \text{10}^{\text{-1}}\text{ dm}^{\text{3}}}=\text{1}\text{.540 }\times 10^{^{\text{-1}}}\text{mol dm}^{\text{-3}}\) = 0.1540 mol L -1Las soluciones salinas isotónicas tienen la misma “osmolaridad” que el plasma sanguíneo, por lo que son isotónicas con él y los glóbulos rojos. La solución salina intravenosa isotónica es de 9 g de NaCl en 1000 mL de agua, o aproximadamente 0,15 M de NaCl, como vemos anteriormente. Su osmolaridad es de 0.30 Osm (“osmolar”), debido a que cada uno de los dos iones, Na + y Cl - afectan a la ósmosis, y el NaCl 0.15 M da 0.30 M de concentración total de iones.
Nótese que la definición de concentración es totalmente análoga a las definiciones de densidad, masa molar y relación estequiométrica que hemos encontrado anteriormente. La concentración servirá como factor de conversión relacionando el volumen de solución con la cantidad de soluto disuelto.
\(\text{Volume of solution}\overset{concentration}{\longleftrightarrow}\text{amount of solute}\)\(V\overset{c}{\longleftrightarrow}n\)Debido a que el volumen de un líquido se puede medir rápida y fácilmente, la concentración es una cantidad muy utilizada. Los siguientes dos ejemplos muestran cómo se puede aplicar este factor de conversión a soluciones comúnmente encontradas en las que el agua es el disolvente (soluciones acuosas).
Existen diversos fluidos intravenosos que se utilizan en los hospitales. “D5W” solo contiene glucosa; NS solo contiene Cloruro de Sodio; La Solución LR contiene Sodio, Cloruro, Lactato, Potasio y Calcio. Si D5W [1] tiene una concentración de 0.2520 mol dm —3, ¿qué cantidad (en mol) de glucosa se administra a un paciente en 24.71 cm 3 (24.71 ml) de esta solución?
Solución
Usando la concentración como factor de conversión, tenemos
-
- \(V\text{ }\xrightarrow{c}\text{ }n\)
\(=\text{24}\text{.71 cm}^{\text{3}}\times \frac{\text{0}\text{.2520 mol}}{\text{1 dm}^{\text{3}}}\times \frac{\text{1 dm}^{\text{3}}}{\text{10}^{\text{3}}\text{ cm}^{\text{3}}}\)
= 0.006 227 mol
Alternativamente, 24.71 mL x\(\frac{\text{1 liter}}{\text{1000 mL}} x \frac{\text{0.2520 mol}}{liter} = \text{0.006227 mol}\)
Las unidades de concentración de moles por decímetro cúbico suelen abreviarse M, pronunciado molar. Es decir, una solución 0.1- M (una décima molar) contiene 0.1 mol de soluto por decímetro cúbico de solución. Esta abreviatura es muy conveniente para etiquetar botellas de laboratorio y para escribir problemas de libros de texto; sin embargo, al hacer cálculos, es difícil ver eso\(\text{1 dm}^{\text{3}}\times \text{1 }\text{M}=\text{1mol}\) Por lo tanto te recomendamos que siempre escribas las unidades en su totalidad al hacer cualquier cálculo que implique solución concentraciones. Es decir,
\(\text{1 dm}^{\text{3}}\times \text{1 }\dfrac{\text{mol}}{\text{dm}^{\text{3}}}=\text{1mol}\)
\(\text{1 L}\times \text{1 }\dfrac{\text{mol}}{\text{L}}=\text{1mol}\)
Problemas como el Ejemplo 2 son más fáciles de resolver para algunas personas si la concentración de la solución se expresa en milimoles por centímetro cúbico (mmol cm —3) en lugar de moles por decímetro cúbico. Dado que el prefijo SI m significa 10 —3, 1 mmol = 10 —3 mol, y
\(\text{1 M} ~ = ~ \dfrac{\text{1 mol}}{\text{1 dm}^{\text{3}}} ~ \times ~ \dfrac{\text{1 dm}^{\text{3}}}{\text{1 L}} ~ = ~ \dfrac{\text{1 mol}}{\text{L}}\)
\(\text{1 M} ~ = ~ \dfrac{\text{1 mol}}{\text{L}} ~ \times ~ \dfrac{\text{10}^{\text{-3}}\text{ L}}{\text{1 ml}} ~ \times ~ \dfrac{\text{1 mmol}}{\text{10}^{\text{-3}}\text{ mol}} ~ = ~ \dfrac{\text{1 mmol}}{\text{1 ml}}\)
\(\text{1 M} ~ = ~ \dfrac{\text{1 mol}}{\text{1 dm}^{\text{3}}} \times \dfrac{\text{1 dm}^{\text{3}}}{\text{10}^{\text{3}}\text{ cm}^{\text{3}}} \times \dfrac{\text{1 mmol}}{\text{10}^{\text{-3}}\text{ mol}} ~ = ~ \dfrac{\text{1 mmol}}{\text{1 cm}^{\text{3}}} \)
Así, una concentración de 0.1396 mol dm —3 (0.1396 M) también se puede expresar como 0.1396 mmol cm —3. Expresar la concentración de esta manera es muy conveniente cuando se trata de cristalería de laboratorio calibrada en mililitros o centímetros cúbicos.
Exactamente 250 ml de solución NS (Salina Normal) I.V. cuya concentración es de 0.154 M en NaCl se suministraron de una pipeta. a) ¿Qué cantidad de NaCl estaba presente? b) ¿Qué masa de NaCl quedaría si toda el agua se evaporara?
Solución
a) Dado que 0.154 M significa 0.154 mol dm —3, o 0.154 mmol cm —3, elegimos esta última, cantidad más conveniente como factor de conversión:
\(n_{\text{NaCl}}=\text{250}\text{.0 cm}^{\text{3}}\times \frac{\text{0}\text{.154 mol}}{\text{1 cm}^{\text{3}}}=\text{38}\text{.5 mmol}=\text{38}\text{.5}\times 10^{\text{-3}}\text{ mol}\)b) Usando masa molar, obtenemos\(\text{m}_{\text{NaCl}}=\text{38}\text{.5}\times 10^{\text{-3}}\text{ mol}\times \frac{\text{58}\text{.443 g}}{\text{1 mol}}=2.\text{25}\text{g}\) Nota: Los símbolos n NaCl y m NaCl se refieren a la cantidad y masa del soluto NaCl, respectivamente. No se refieren a la solución. Si quisiéramos especificar la masa de solución acuosa de NaOH, se podría usar el símbolo m NaCl (ac).De ChemPrime: 3.10: Concentraciones de solución










