3.11.3: Medio ambiente - Determinación de la pureza del agua a través de la demanda biológica
- Page ID
- 76048
Antes de estudiar esta sección, es posible que desee revisar sus cálculos de solución y sus cálculos molares.
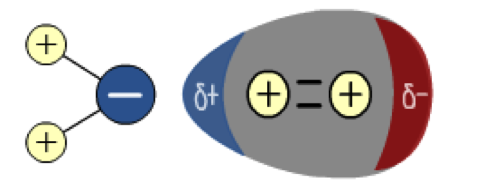
La vida acuática depende de los gases disueltos en el agua en la que viven. Los gases, como el dióxido de carbono (CO 2) serán requeridos por las plantas acuáticas para la fotosíntesis, mientras que la mayoría de las plantas y animales acuáticos requieren oxígeno para la respiración anaeróbica. Los microorganismos también requerirán oxígeno a medida que van descomponiendo la materia orgánica. Un indicador importante de la calidad del agua es el contenido de oxígeno disuelto del agua. A una presión de 1atm y una temperatura de 20 o C, la solubilidad máxima del oxígeno es de aproximadamente 9ppm, lo que equivale a 0.009 g dm -3. El oxígeno, al ser una molécula no polar, tiene una baja solubilidad en agua, que es un disolvente polar. La molécula de agua polar induce un momento dipolar en la molécula de oxígeno y las dos moléculas son ahora débilmente atraídas.
El siguiente diagrama muestra la molécula de agua polar de la izquierda induciendo un momento dipolar en la molécula de oxígeno no polar que conduce a una débil fuerza de atracción;
Para asegurar una comunidad acuática equilibrada y diversa, el contenido de oxígeno no debe caer por debajo de 6ppm, aunque algunas especies de peces pueden sobrevivir en ambientes con contenidos de oxígeno tan bajos como 3ppm. Las bacterias son capaces de sobrevivir en el agua con niveles aún más bajos de oxígeno.
Cuando la materia orgánica se descompone aeróbicamente en el agua, las bacterias responsables de este proceso consumen parte del oxígeno disuelto presente en el agua. La cantidad de oxígeno requerida por las bacterias para descomponer esta materia orgánica se define como la demanda biológica de oxígeno (DBO). Esto a menudo se mide en un volumen fijo de agua durante un período de tiempo fijo como 5 días.
Si el agua tiene un DBO alto sin los medios para reponer el oxígeno usado, entonces muy pronto no podrá soportar la vida acuática. Existe un alto riesgo de que esto suceda en cuerpos de agua que están quietos y no tienen mucha mezcla mecánica, por ejemplo lagos y estanques, mientras que los ríos de flujo rápido son capaces de reponer este oxígeno a través de la acción mecánica de su flujo.
Entonces, ¿qué factores podrían provocar un aumento en la DBO? Si los materiales biodegradables excesivos encuentran su camino hacia el agua, esto conducirá a un aumento en las bacterias en descomposición y de ahí un aumento en la DBO. Las posibles fuentes de este material incluyen el alcantarillado y los desechos industriales de procesamiento de alimentos o fábricas de papel. La DBO del agua también puede aumentar debido a la adición de nutrientes como nitratos y fosfatos que se pueden encontrar en fertilizantes o detergentes para ropa. Esto provoca un aumento en el crecimiento de algas, que eventualmente muere, y se descompone. A medida que el crecimiento de las plantas se vuelve excesivo, el volumen de material orgánico muerto y en descomposición aumenta rápidamente. Esta descomposición requiere O 2, lo que lleva al agotamiento de O 2 en el agua.
Podemos utilizar valores de DBO como indicador de la calidad del agua.
| Cuerpo/PPM | Calidad del agua |
|---|---|
| < 1 | Agua casi pura |
| 5 | Pureza dudosa |
| 10 | Calidad inaceptable |
| 100 - 400 | Residuos de alcantarillado sin tratar |
| 100 - 10000 | Residuos del procesamiento de carne |
El DBO de una muestra de agua se puede probar usando una titulación redox llamada método Winkler. El principio del método Winkler es el siguiente; el oxígeno en una muestra de agua se hace para oxidar iones yoduro en yodo. La cantidad de yodo producida se determina titulando con una solución estándar de tiosulfato. La cantidad de oxígeno presente en la muestra original de agua se puede determinar a partir del título.
Las reacciones se resumen de la siguiente manera:
1) 2 Mn 2 + (aq) + 4 OH - (aq) + O 2 (aq) → 2 MnO 2 (s) + 2 H 2 O (l)
2) MnO 2 (s) + 4 H + (aq) + 2 I - (aq) → Mn 2 + (aq) + I 2 (aq) + 2 H 2 O (l)
3) I 2 (aq) + 2 S 2 O 3 2 - (aq) → S 4 O 6 2 - (aq) + 2 I - (aq)
Siguiendo los pasos descritos anteriormente, por favor calcule lo siguiente.
Una muestra de 500 cm 3 de agua se saturó con oxígeno y se dejó durante 5 días. El contenido final de oxígeno se midió utilizando la secuencia de reacciones resaltada anteriormente. Se encontró que se requirió 5.00cm 3 de una solución 0.0500 mol dm -3 de Na 2 S 2 O 3 (aq) para reaccionar con el yodo producido.
a) Calcular cuántos moles de Na 2 S 2 O 3 (ac) reaccionaron con el yodo en la reacción (3)
b) Deducir cuántos moles de yodo se habían producido en la reacción (2).
c) Deducir cuántos moles de MnO 2 (s) se habían producido en la reacción (1).
d) Deducir cuántos moles de O 2 (g) estaban presentes en el agua.
e) Calcular la solubilidad del oxígeno en el agua en g dm -3.
f) Supongamos que la solubilidad máxima del agua es 0.009 g dm -3 y deducir el DBO de la muestra de agua.
Solución
a) Cantidad de Na 2 S 2 O 3 (aq) = 5.00 x 0.0500/1000 = 2.5 x 10 -4 moles.
b) Cantidad de I 2 (aq) = ½ (2.50 x 10 -4 moles) = 1.25 x 10 -4 moles.
c) Cantidad de MnO 2 (s) = 1.25 x 10 -4 moles.
d) Cantidad de O 2 (g) = ½ (1.25 x 10 -4) moles = 6.25 x 10 -5 moles.
e) Cantidad de O2 (g) en 1dm3 = 1.25 x 10-4 moles Masa en 1dm3 = 0.004 g dm-3
f) Oxígeno utilizado por bacterias (DBO) = 0.009 g dm -3 — 0.004 g dm -3 = 0.005 g dm -3


