3.13: Titulaciones
- Page ID
- 76053
Una titulación es una técnica volumétrica en la que se agrega una solución de un reactivo (el valorante) a una solución de un segundo reactivo (el “analito”) hasta alcanzar el punto de equivalencia. El punto de equivalencia es el punto en el que se ha agregado el valorante en la cantidad exacta para reaccionar estequiométricamente con el analito (cuando moles de valorante = moles de analito). Si bien el valorante o el analito está coloreado, el punto de equivalencia es evidente a partir de la desaparición del color a medida que se consumen los reactivos. De lo contrario, se puede agregar un indicador que tenga un “punto final” (cambia de color) en el punto de equivalencia, o el punto de equivalencia puede determinarse a partir de una curva de titulación. La cantidad de valorante añadido se determina a partir de su concentración y volumen:
n (mol) = C (mol /L) * V (L)
y la cantidad de valorante se puede utilizar en el cálculo estequiométrico habitual para determinar la cantidad de analito.
El proceso de titulación se puede observar en el siguiente video.
Un volumen medido de la solución a valorar, en este caso, ácido acético acuoso incoloro, CH 3 COOH (ac) se coloca en un vaso de precipitados. El hidróxido de sodio incoloro NaOH (ac), que es el titulante, se agrega cuidadosamente por medio de una bureta. El volumen de valorante agregado puede entonces determinarse leyendo el nivel de líquido en la bureta antes y después de la titulación. Esta lectura suele estimarse a la centésima de mililitro más cercana, por lo que se pueden hacer rápidamente adiciones precisas de titulante.
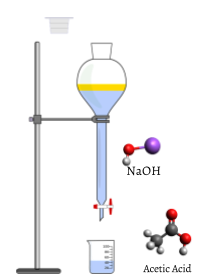
A medida que los primeros mililitros de valorante fluyen hacia el matraz, algún indicador cambia brevemente a rosa, pero vuelve a incoloro rápidamente. Esto se debe a un gran exceso de ácido acético. El reactivo limitante NaOH se consume por completo.
El indicador agregado cambia a rosa cuando se completa la titulación, lo que indica que todo el ácido acético acuoso ha sido consumido por NaOH (ac). La reacción que se produce es
\[ \text{C} \text{H}_{3} \text{COOH} (aq) + \text{ NaOH} (aq) \rightarrow \text{ Na}^{+} (aq) + \text{CH}_{3} \text{COO}^{-} (aq) + \text{H}_{2} \text{O} (l) \label{2} \]
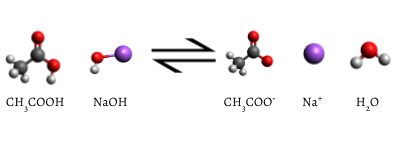
Eventualmente, se consume todo el ácido acético. La adición de incluso una fracción de una gota de valorante produce un color rosa duradero debido al NaOH sin reaccionar en el matraz. El cambio de color que se produce en el punto final del indicador señala que se ha consumido todo el ácido acético, por lo que hemos alcanzado el punto de equivalencia de la titulación. Si se agregara un poco más de solución de NaOH, habría un exceso y el color de la solución en el matraz se volvería mucho más oscuro. El punto final aparece repentinamente y se debe tener cuidado de no sobrepasar el punto final.
Después de que la titulación haya alcanzado el punto final, se lee un volumen final de la bureta. Utilizando la lectura inicial y final, el volumen agregado se puede determinar con bastante precisión:
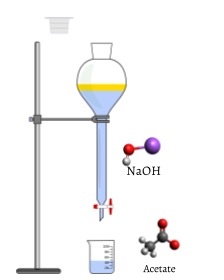
El objeto de una titulación siempre es agregar solo la cantidad de valorante necesaria para consumir exactamente la cantidad de sustancia que se está valorando. En la reacción de NaOH—CH 3 COOH Ec. \(\ref{2}\), el punto de equivalencia ocurre cuando se ha agregado una cantidad molar igual de NaOH del cilindro graduado por cada mol de CH 3 COOH originalmente en el matraz de titulación. Es decir, en el punto de equivalencia la relación de la cantidad de NaOH, añadida a la cantidad de CH 3 COOH consumida debe ser igual a la relación estequiométrica
\[\dfrac{n_{\text{NaOH}}\text{(added from graduated cylinder)}}{n_{\text{CH}_{\text{3}}{\text{COOH}}}\text{(initially in flask)}}=\text{S}( \dfrac{\text{NaOH}}{\text{CH}_{\text{3}}\text{COOH}} ) \nonumber \]
\[=\dfrac{\text{1 mol NaOH}}{\text{1 mol CH}_{\text{3}}\text{COOH}} \nonumber \]
Qué volumen de 0.05386 M KMnO 4 sería necesario para alcanzar el punto final al valorar 25.00 ml de 0.1272 M H 2 O 2, dado S (KMnO 4/H 2 O 2) = 2/5
Solución
En el punto de equivalencia, se aplicará la relación estequiométrica, y podemos utilizarla para calcular la cantidad de KMnO 4 que hay que sumar:
\[n_{\text{KMnO}_{\text{4}}}\text{(added)}=n_{\text{H}_{\text{2}}\text{O}_{\text{2}}}\text{(in flask)}\times \text{S}\left( \dfrac{\text{KMnO}_{\text{4}}}{\text{H}_{\text{2}}\text{O}_{\text{2}}} \right) \nonumber \]
La cantidad de H 2 O 2 se obtiene del volumen y concentración:
\[n_{\text{H}_{\text{2}}\text{O}_{\text{2}}}\text{(in flask)}=25.00\text{ cm}^{\text{3}}\times \text{0}\text{.1272 }\dfrac{\text{mmol}}{\text{cm}^{\text{3}}}=\text{3}\text{.180 mmol H}_{\text{2}}\text{O}_{\text{2}} \nonumber \]
Entonces
\[n_{\text{KMnO}_{\text{4}}}\text{(added)}=\text{3}\text{.180 mmol H}_{\text{2}}\text{O}_{\text{2}}\times \dfrac{\text{2 mol KMnO}_{\text{4}}}{\text{5 mol H}_{\text{2}}\text{O}_{\text{2}}}\times \dfrac{\text{10}^{\text{-3}}}{\text{10}^{\text{-3}}} \nonumber \]
\[=\text{3}\text{.180 mmol H}_{\text{2}}\text{O}_{\text{2}}\times \dfrac{\text{2 mmol KMnO}_{\text{4}}}{\text{5 mmol H}_{\text{2}}\text{O}_{\text{2}}} \nonumber \]
= 1.272 mmol KMnO 4
Para obtener V KMnO4 (aq) utilizamos la concentración como factor de conversión:
\[V_{\text{KMnO}_{\text{4}}\text{(}aq\text{)}}=\text{1}\text{.272 mmol KMnO}_{\text{4}}\times \dfrac{\text{1 cm}^{\text{3}}}{\text{5}\text{.386}\times \text{10}^{\text{-2}}\text{ mmol KMnO}_{\text{4}}} \nonumber \]
= 23.62 cm 3
Obsérvese que la sobrevaloración [agregar más de 23.62 cm 3 de KMnO 4 (aq) implicaría un exceso (más de 1.272 mmol) de KMnO 4.
La titulación se utiliza a menudo para determinar la concentración de una solución. En muchos casos no es sencillo obtener una sustancia pura, pesarla con precisión y disolverla en un matraz aforado como se hizo en el Ejemplo 1 de Concentraciones en Solución. NaOH, por ejemplo, se combina rápidamente con H 2 O y CO 2 del aire, por lo que incluso una muestra recién preparada de NaOH sólido no será pura. Su peso cambiaría continuamente a medida que se absorbieron CO 2 (g) y H 2 O (g). El cloruro de hidrógeno (HCl) es un gas a temperaturas y presiones ordinarias, lo que lo hace muy difícil de manejar o pesar. Las soluciones acuosas de ambas sustancias deben estar estandarizadas; es decir, sus concentraciones deben ser determinadas por titulación.
Se disuelve en agua destilada una muestra de hidrógeno ftalato de potasio puro (KHC 8 H 4 O 4) que pesa 0.3421 g. La valoración de la muestra requiere 27.03 ml de NaOH (ac). La reacción de titulación es
\[ \text{NaOH} (aq) + \text{KHC}_{8} \text{H}_{4} \text{O}_{4} (aq) \rightarrow \text{NaKC}_{8} \text{H}_{4} \text{O}_{4} (aq) + \text{H}_{2} \text{O} \nonumber \]
¿Cuál es la concentración de NaOH (aq)?
Solución
Para calcular la concentración, necesitamos conocer la cantidad de NaOH y el volumen de solución en la que se disuelve. La primera cantidad podría obtenerse a través de una relación estequiométrica a partir de la cantidad de KHC 8 H 4 O 4, y esa cantidad se puede obtener de la masa
\[m_{\text{KHC}_{\text{8}}\text{H}_{\text{4}}\text{O}_{\text{4}}}\text{ }\xrightarrow{M_{\text{KHC}_{\text{8}}\text{H}_{\text{4}}\text{O}_{\text{4}}}}\text{ }n_{\text{KHC}_{\text{8}}\text{H}_{\text{4}}\text{O}_{\text{4}}}\text{ }\xrightarrow{S\text{(NaOH/KHC}_{\text{8}}\text{H}_{\text{4}}\text{O}_{\text{4}}\text{)}}\text{ }n_{\text{NaOH}} \nonumber \]
\[n_{\text{NaOH}}=\text{3}\text{.180 g}\times \dfrac{\text{1 mol KHC}_{\text{8}}\text{H}_{\text{4}}\text{O}_{\text{4}}}{\text{204}\text{.22 g}}\times \dfrac{\text{1 mol NaOH}}{\text{1 mol KHC}_{\text{8}}\text{H}_{\text{4}}\text{O}_{\text{4}}} \nonumber \]
\[=\text{1}\text{.674 }\times 10^{\text{-3}}\text{ mol NaOH}=\text{1}\text{.675 mmol NaOH} \nonumber \]
La concentración es
\[c_{\text{NaOH}}=\dfrac{n_{\text{NaOH}}}{V}=\dfrac{\text{1}\text{.675 mmol NaOH}}{\text{27}\text{.03 cm}^{\text{3}}}=\text{0}\text{.06197 mmol cm}^{\text{-3}} \nonumber \]
o 0.06197 M.
Con mucho, el uso más común de titulaciones es en determinar incógnitas, es decir, en determinar la concentración o cantidad de sustancia en una muestra de la que inicialmente no sabíamos nada. El siguiente ejemplo involucra un desconocido que muchas personas encuentran todos los días.
Las tabletas de vitamina C contienen ácido ascórbico (C 6 H 8 O 6) y un “relleno” de almidón que las mantiene unidas. Para determinar cuánta vitamina C está presente, una tableta se puede disolver en agua y con solución de hidróxido de sodio, NaOH (aq). La ecuación es
\[ \text{C}_{6} \text{H}_{8} \text{O}_{6} (aq) + \text{NaOH} (aq) \rightarrow \text{ Na C}_{6} \text{H}_{7} \text{O}_{6} (aq) + \text{H}_{2} \text{O} (l) \nonumber \]
Si la titulación de una tableta de vitamina C disuelta requiere 16.85 cm³ de NaOH 0.1038 M, ¿qué tan precisa es la afirmación en la etiqueta del frasco de que cada comprimido contiene 300 mg de vitamina C?
Solución
El volumen y concentración conocidos nos permiten calcular la cantidad de NaOH (ac) que reaccionó con toda la vitamina C. Usando la relación estequiométrica
\[\text{S}\left( \dfrac{\text{C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}{\text{NaOH}} \right)=\dfrac{\text{1 mmol C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}{\text{1 mmol NaOH}} \nonumber \]
podemos obtener la cantidad de C 6 H 8 O 6. La masa molar convierte esa cantidad en una masa que puede compararse con la etiqueta. Esquemáticamente
\[ \begin{align} & V_{\text{NaOH}}\rightarrow{c_{\text{NaOH}}}n_{\text{NaOH}}\rightarrow{\text{S(C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}\text{/NaOH)}}n_{\text{C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}\rightarrow{M_{\text{C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}}\text{m}_{\text{C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}} \\ & \text{m}_{\text{C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}=\text{16}\text{.85 cm}^{\text{3}}\times \dfrac{\text{0}\text{.1038 mmol NaOH}}{\text{1 cm}^{\text{3}}}\times \dfrac{\text{1 mmol C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}{\text{1 mmol NaOH}}\times \dfrac{\text{176}\text{.1 mg }}{\text{mmol C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}} \\ & = 308.0 \text{ mg} \end{align} \nonumber \]
Obsérvese que la masa molar de C 6 H 8 O 6
\[\dfrac{\text{176}\text{.1 g }}{\text{1 mol C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}=\dfrac{\text{176}\text{.1 g }}{\text{1 mol C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}\times \dfrac{\text{10}^{\text{-3}}}{\text{10}^{\text{-3}}} \nonumber \]
\[=\dfrac{\text{176}\text{.1 g}\times \text{10}^{\text{-3}}\text{ }}{\text{10}^{\text{-3}}\text{ mol C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}}=\dfrac{\text{176}\text{.1 mg }}{\text{1 mmol C}_{\text{6}}\text{H}_{\text{8}}\text{O}_{\text{6}}} \nonumber \]
puede expresarse en miligramos por milimol así como en gramos por mol.
Los 308.0 mg obtenidos en este ejemplo están razonablemente de acuerdo con la afirmación del fabricante de 300 mg. Las tabletas son estampadas por máquinas, no se pesan individualmente, por lo que se espera alguna variación.


