3.12: Soluciones para diluir y mezclar
- Page ID
- 75992
|
Cómo Diluir una Solución Carolinabiológica |
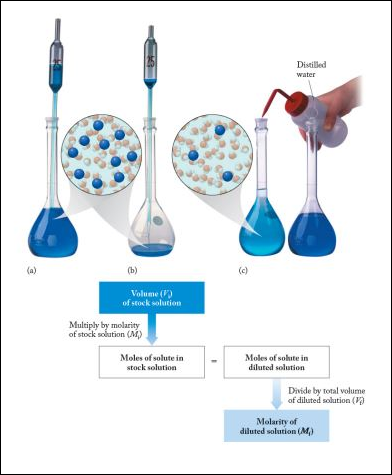
|
A menudo es conveniente preparar una serie de soluciones de concentraciones conocidas preparando primero una solución madre única como se describe en el Ejemplo 1 a partir de Concentraciones de Solución. Las alícuotas (volúmenes cuidadosamente medidos) de la solución madre se pueden diluir a cualquier volumen deseado. En otros casos puede ser inconveniente pesar con precisión una masa de muestra lo suficientemente pequeña para preparar un pequeño volumen de una solución diluida. Cada una de estas situaciones requiere que se diluya una solución para obtener la concentración deseada.
Se utiliza una pipeta para medir 50.0 ml de HCl 0.1027 M en un matraz aforado de 250.00-ml. El agua destilada se agrega cuidadosamente hasta la marca en el matraz. ¿Cuál es la concentración de la solución diluida?
Solución
Para calcular la concentración, primero se obtiene la cantidad de HCl en los 50.0 ml (50.0 cm 3) de solución añadida al matraz aforado:
\[n_{\text{HCl}}=\text{50}\text{.0 cm}^{\text{3}}\text{ }\times \text{ }\dfrac{\text{0}\text{.1027 mmol}}{\text{1 cm}^{\text{3}}}=\text{5}\text{.14 mmol} \nonumber \]
Dividir por el nuevo volumen da la concentración
\[c_{\text{HCl}}=\dfrac{n_{\text{HCl}}}{V}=\dfrac{\text{5}\text{.14 mmol}}{\text{250}\text{.00 cm}^{\text{3}}}=\text{0.0205 mmol cm}^{\text{-3}} \nonumber \]
Así la nueva solución es 0.0205 M.
Alternativamente,
\[n_{\text{HCl}}=\text{50}\text{.0 mL} ~\times~ \dfrac{\text{10}^{-3}\text{L}}{\text{1 ml}} ~\times~\dfrac{\text{0}\text{.1027 mol}}{\text{1 L}} \nonumber \]
\[~=~\text{5.14}\times{10}^{-3}\text{mol} \nonumber \]
\[c_{\text{HCl}}=\dfrac{n_{\text{HCl}}}{V} ~ = ~ \dfrac{\text{5}\text{.14}\times\text{10}^{-3}\text{mol}}{\text{250.00 ml}~\times~\dfrac{1 \text{ml}}{\text{10}^{-3}\text{L}}} \nonumber \]
\[~ = ~ \text{0.0205 mol/L} \nonumber \]
¿Qué volumen de la solución de 0.316 46 M KI preparada en el Ejemplo 1 a partir de Concentraciones en Solución se requeriría para hacer 50.00 ml de 0.0500 M KI?
Solución
Utilizando el volumen y concentración de la solución deseada, podemos calcular la cantidad de KI requerida. Entonces se puede utilizar la concentración de la solución original (0.316 46 M) para convertir esa cantidad de KI al volumen necesario. Esquemáticamente
\[\begin{align} & V_{\text{new}}\xrightarrow{c_{\text{new}}}n_{\text{KI}}\xrightarrow{c_{\text{old}}}V_{\text{old}} \\ & \\ & V_{\text{old}}=\text{50}\text{.00 cm}^{\text{3}}\text{ }\times \text{ }\dfrac{\text{0}\text{.0500 mmol}}{\text{1 cm}^{\text{3}}}\text{ }\times \text{ }\dfrac{\text{1 cm}^{\text{3}}}{\text{0}\text{.316 46 mmol}}\text{ }=\text{7}\text{.90 cm}^{\text{3}} \\ \end{align} \nonumber \]
Por lo tanto, debemos diluir una alícuota de 7.90 ml de la solución madre a 50.00 ml. Esto podría hacerse midiendo 7.90 ml de una bureta en un matraz aforado de 50.00-ml y agregando agua hasta la marca.
Obsérvese que el cálculo anterior puede simplificarse, ya que se utilizó la concentración y el volumen de una solución concentrada (C conc y V conc) para calcular la cantidad de soluto, y esta cantidad se transfirió completamente a la solución diluida:
\[ C_{conc} \times V_{conc} = n_{conc} = n_{dil} = C_{dil} \times V_{dil} \nonumber \]
Entonces
\[ C_{conc} \times V_{conc} = C_{dil} \times V_{dil} \nonumber \]
Entonces, por ejemplo\(\PageIndex{2}\),
\[( 0.316 46 M ) \times (V_{conc}) = (50.00 \text{ ml} ) \times ( 0.0500 M) \nonumber \]
\[ V_{conc} = 7.90 \text{ mL} \nonumber \], que se diluirá a 50.00 mL como antes.
Tenga en cuenta que el volumen calculado tendrá las mismas dimensiones que el volumen de entrada, y el análisis dimensional nos dice que en este caso no necesitamos convertir a litros, ya que L cancela cuando dividimos M (mol/L) por M (mol/L).


