5.2: Electrones y valencia
- Page ID
- 75486
A nivel químico, una pista importante para el desentrañamiento de la estructura electrónica de los átomos es la existencia de gases nobles, que son casi completamente incapaces de formar compuestos químicos. Esta falta de reactividad sugiere que los átomos de estos elementos tienen estructuras que no permiten la interacción con las estructuras de otros átomos. Una segunda pista es la estrecha correspondencia entre la valencia de un elemento y la medida en que su número atómico difiere del del gas noble más cercano. Los elementos que tienen una valencia de 1, por ejemplo, tienen números atómicos uno más o uno menos que el de un gas noble. Así, los átomos de los metales alcalinos Li, Na, K, Rb y Cs contienen un electrón más que los correspondientes gases nobles He, Ne, Ar, Kr y Xe, mientras que los átomos de hidrógeno H y los halógenos F, Cl, Br e I contienen un electrón menos. Observaciones similares se aplican a una valencia de 2. Los átomos de metales alcalinotérreos Be, Mg, Ca, Sr y Ba contienen dos electrones más que un átomo de gas noble, mientras que los elementos O, S, Se y Te contienen dos electrones menos. Exactamente el mismo patrón de comportamiento también se extiende a elementos con una valencia de 3 o 4.
Ya en 1902, Lewis comenzó a sugerir (en sus conferencias a estudiantes de química general, nada menos) que el comportamiento que acababa de describir podría explicarse asumiendo que los electrones en los átomos estaban dispuestos en conchas, estando todos los electrones en la misma concha aproximadamente a la misma distancia del núcleo. Las imágenes que finalmente desarrolló para los átomos de helio, cloro y potasio se ilustran a continuación. En el átomo de helio los dos electrones ocupan solo una concha, en el átomo de cloro los 17 electrones están dispuestos en tres conchas, y en el átomo de potasio los 19 electrones ocupan cuatro conchas. Lewis sugirió que cada caparazón solo puede acomodar tantos electrones. Una vez que se ha alcanzado este número, la cáscara debe ser considerada como llena, y cualquier electrón adicional se acomoda en la siguiente capa, algo más lejos del núcleo. Una vez que se llena una concha, además, se supone que tiene una estructura particularmente estable que impide que los electrones en la cubierta se involucren con otros átomos. Por lo tanto, son solo los electrones en la capa más externa incompleta llena (llamados electrones de valencia) los que tienen alguna importancia química. Además, si se llena la capa más externa, entonces el átomo resultante tendrá poca o ninguna tendencia a reaccionar con otros átomos y formar compuestos con ellos. Dado que este es exactamente el comportamiento exhibido por los gases nobles, Lewis concluyó que el rasgo característico de un átomo de un gas noble es una capa externa llena de electrones.
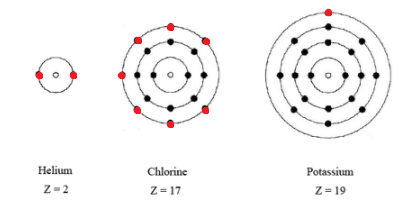
Suponiendo que todos los gases nobles contienen una cáscara llena más externa, ahora es bastante sencillo calcular cuántos electrones pueden acomodarse en cada caparazón. Dado que el primer gas noble helio tiene dos electrones, sabemos que solo se necesitan dos electrones para llenar la primera concha. Otros ocho electrones nos llevan al siguiente neón de gas noble (Z = 10). En consecuencia deducimos que el segundo caparazón puede acomodar un máximo de ocho electrones. Un argumento similar lleva a la conclusión de que la tercera capa también requiere ocho electrones para llenarla y que un átomo de argón tiene dos electrones en la primera capa, ocho en la segunda y ocho en la tercera, un total de 18 electrones.


