5.3: Diagramas de Lewis
- Page ID
- 75500
Lewis utilizó diagramas simples (ahora llamados diagramas de Lewis) para realizar un seguimiento de cuántos electrones estaban presentes en la capa más externa, o valencia, de un átomo dado. El núcleo del átomo, es decir, el núcleo junto con los electrones internos, está representado por el símbolo químico, y solo los electrones de valencia se dibujan como puntos que rodean al símbolo químico. Así, los tres átomos mostrados en la Figura 1 de Electrones y Valencia pueden ser representados por los siguientes diagramas de Lewis:
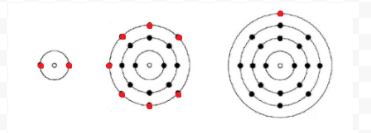
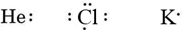
Si el átomo es un átomo de gas noble, son posibles dos procedimientos alternativos. O podemos considerar que el átomo tiene electrones de valencia cero o podemos considerar la cáscara llena más externa como la capa de valencia. Los tres primeros gases nobles pueden escribirse así como:
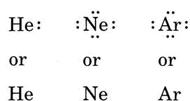
Dibuja diagramas de Lewis para un átomo de cada uno de los siguientes elementos: Li, N, F, Na
Solución
Encontramos por la tabla periódica dentro de la portada que Li tiene un número atómico de 3. Contiene así tres electrones, uno más que el gas noble He. Esto significa que la capa más externa, o valencia, contiene solo un electrón, y el diagrama de Lewis es
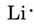
Siguiendo el mismo razonamiento, N tiene siete electrones, cinco más que He, mientras que F tiene nueve electrones, siete más que He, dando
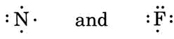
Na tiene nueve electrones más que He, pero ocho de ellos están en el núcleo, correspondientes a los ocho electrones en la capa más externa de Ne. Dado que Na tiene solo 1 electrón más que Ne, su diagrama de Lewis es
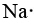
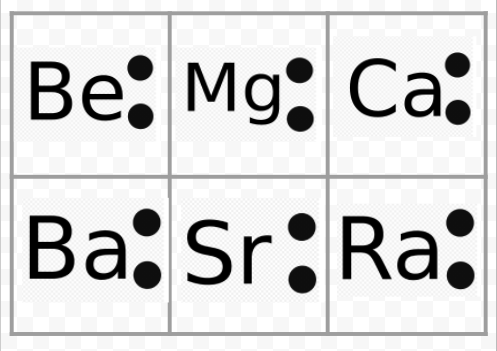
Observe del ejemplo anterior que los diagramas de Lewis de los metales alcalinos son idénticos a excepción de sus símbolos químicos. Esto concuerda muy bien con el comportamiento químico muy similar de los metales alcalinos. De igual manera, los diagramas de Lewis para todos los elementos de otros grupos, como los alcalinotérreos o los halógenos, tienen el mismo aspecto.
Los diagramas de Lewis también se pueden utilizar para predecir las valencias de los elementos. Lewis sugirió que el número de valencias de un átomo era igual al número de electrones en su caparazón de valencia o al número de electrones que tendrían que agregarse a la capa de valencia para lograr la estructura electrónica de la carcasa del siguiente gas noble. Como ejemplo de esta idea, considera los elementos Be y O. Sus diagramas de Lewis y los de los gases nobles He y Ne son

Comparando Be con He, vemos que el primero tiene dos electrones más y por lo tanto debería tener una valencia de 2. Se podría esperar que el elemento O tenga una valencia de 6 o una valencia de 2 ya que tiene seis electrones de valencia, dos menos que Ne. Utilizando reglas de valencia desarrolladas de esta manera, Lewis pudo dar cuenta del aumento y disminución regular de los subíndices de los compuestos en la tabla que se encuentra en la sección Valence, y se reproduce aquí. Además pudo dar cuenta de más del 50 por ciento de las fórmulas de la tabla. (Los que concuerdan con sus ideas están sombreados de color en la tabla. Es posible que desee referirse ahora a esa tabla y verificar que algunas de las fórmulas indicadas siguen las reglas de Lewis.) El éxito de Lewis en este sentido dio una clara indicación de que los electrones fueron el factor más importante para mantener unidos los átomos cuando se formaron las moléculas.
A pesar de estos éxitos, también hay dificultades que se encuentran en las teorías de Lewis, en particular para los elementos más allá del calcio en la tabla periódica. El elemento Br (Z = 35), por ejemplo, tiene 17 electrones más que el gas noble Ar (Z = 18). Esto nos lleva a concluir que Br tiene 17 electrones de valencia, lo que hace que sea incómodo explicar por qué Br se parece tanto a Cl y F a pesar de que estos dos átomos tienen sólo siete electrones de valencia.
| Element | Peso atómico | Compuestos de Hidrógeno | Compuestos de Oxígeno | Compuestos de Cloro |
|---|---|---|---|---|
| Hidrógeno | 1.01 | H 2 | H 2 O, H 2 O 2 | HCl |
| Helio | 4.00 | Ninguno formado | Ninguno formado | Ninguno formado |
| Litio | 6.94 | LiH | Li 2 O, Li 2 O 2 | LiCl |
| Berilio | 9.01 | BeH 2 | BeO | BecL 2 |
| Boro | 10.81 | B 2 H 6 | B 2 O 3 | BCl 3 |
| Carbono | 12.01 | CH 4, C 2 H 6, C 3 H 8 | CO 2, CO, C 2 O 3 | CCl 4, C 2 Cl 6 |
| Nitrógeno | 14.01 | NH 3, N 2 H 4, HN 3 | N 2 O, NO, NO 2, N 2 O 5 | NCl 3 |
| Oxígeno | 16.00 | H 2 O, H 2 O 2 | O 2, O 3 | <Cl 2 O, ClO 2, Cl 2 O 7 |
| Flúor | 19.00 | HF | DE 2, O 2 F 2 | CLF, CLf 3, CLf 5 |
| Neón | 20.18 | Ninguno formado | Ninguno formado | Ninguno formado |
| Sodio | 22.99 | NaH | Na 2 O, Na 2 O 2 | NaCl |
| Magnesio | 24.31 | MgH 2 | MgO | MgCl 2 |
| Aluminio | 26.98 | AlH 3 | Al 2 O 3 | AlCl 3 |
| Silicio | 28.09 | SiH 4, Si 2 H 6 | SiO 2 | SiCl 4, Si 2 Cl 6 |
| Fosforo | 30.97 | PH 3, P 2 H 4 | P 4 O 10, P 4 O 6 | PCl 3, PCl 5, P 2 Cl 4 |
| Azufre | 32.06 | H 2 S, H 2 S 2 | SO 2, SO 3 | S 2 Cl 2, SCl 2, SCl 4 |
| Cloro | 35.45 | HCl | Cl 2 O, ClO 2, Cl 2 O 7 | Cl 2 |
| Potasio | 39.10 | KH | K 2, K 2 O 2, KO 2 | KCl |
| Argón | 39.95 | Ninguno formado | Ninguno formado | Ninguno formado |
| Calcio | 40.08 | CaH 2 | CaO, CaO 2 | CaCl 2 |
| Scandium | 44.96 | Relativamente Inestable | Sc 2 O 3 | SCCl 3 |
| Titanio | 47.90 | TiH 2 | TiO 2, Ti 2 O 3, TiO | TiCL 4, TiCl 3, TiCL 2 |
| Vanadio | 50.94 | VH 2 | V 2 O 5, V 2 O 3, VO 2, VO | VCl 4, VCl 3, VCl 2 |
| Cromo | 52.00 | CrH 2 | Cr 2 O 3, CrO 2, CrO 3 | CrCl 3, CrCl 2 |


