5.4.3: Deportes, Fisiología y Salud- Kayak de Mar y Clapotis
- Page ID
- 75432
La naturaleza de onda del electrón en el deporte, la fisiología y la salud
Los kayakistas clapotisoceanos pueden ser arrojados inesperadamente al aire por olas altas llamadas clapotis [1]. Los clapotis surgen cerca de la costa donde las olas entrantes golpean la orilla, y se reflejan. Las ondas salientes reflejadas se encuentran con las olas entrantes para dar picos de onda muy altos adyacentes a regiones tranquilas. Este video de YouTube muestra un clipotis en la costa de Oregón, y a continuación se muestra una imagen fija de la clapotis. Otros videos muestran efectos similares.
Sorprendentemente, la clapotis proporciona un modelo para el comportamiento de electrones confinados a un núcleo. Como la mayoría de los modelos, el modelo clapotis es defectuoso, porque las olas del océano y la orilla son irregulares. Por lo tanto, los clapotis surgen de manera irregular (aunque a menudo en la misma posición, como mostrará la observación cuidadosa de los videos. Pero las ondas de electrones siguen un patrón fijo y regular como se describe a continuación.
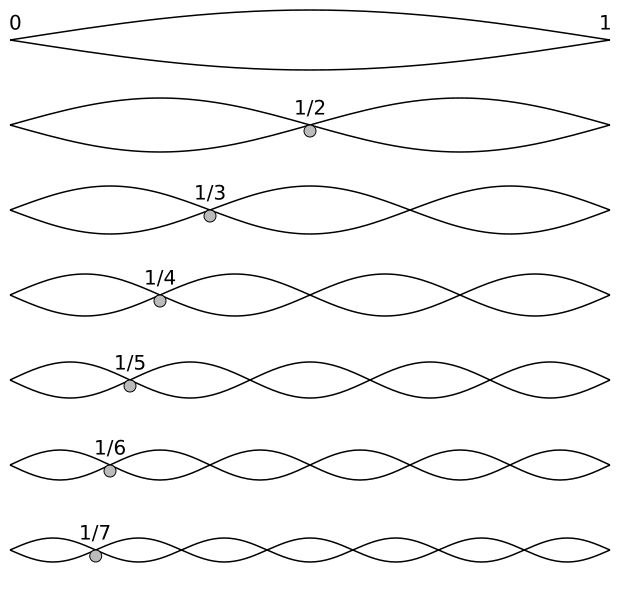
Si las olas fueran perfectamente sinusoidales y la costa fuera perfectamente lineal, la clapotis aparecería constantemente a cierta distancia de la costa, y la distancia puede ser predicha por el modelo de olas que se muestra en un video de YouTube, o en la animación a continuación. La animación es una sección transversal de una ola, pero también podría imaginarse como una ola en una cuerda. El extremo derecho es fijo, y el extremo izquierdo se mueve hacia arriba y hacia abajo. El movimiento hacia arriba y hacia abajo crea una “onda viajera” que se mueve hacia la derecha, golpea el extremo derecho y luego se refleja de nuevo hacia la izquierda. Las olas que se mueven hacia la derecha y hacia la izquierda interfieren para crear un patrón de “onda estacionaria”, donde las crestas de las olas no viajan, sino que se ubican en puntos etiquetados L2 en la animación. Entre las crestas, hay nodos, o puntos donde no hay movimiento en absoluto. De alguna manera el movimiento aparece en ambos lados de los nodos sin ningún movimiento en los nodos en absoluto. Como se puede ver en la animación, la “interferencia constructiva” se produce cuando las crestas de las dos ondas llegan al mismo punto al mismo tiempo, reforzándose entre sí, y produciendo una cresta resultante, o “antinode” que es tan alta como la suma de la alturas de las dos olas (esto se llama el “principio de superposición”). Si una cresta y un valle llegan al mismo punto al mismo tiempo (a medio camino entre L/2 y L/4 en la animación), se produce “interferencia destructiva”, y el principio de superposición predice que se cancelarán entre sí, dando un nodo.
Clapotis en la pared gif [chemwiki.ucdavis.edu]
Una serie de patrones de onda estacionaria discretos “permitidos” son exhibidos por ondas en una cuerda. Los patrones son ligeramente diferentes dependiendo de si la cadena es fija o se le permite moverse en un extremo. A continuación se muestran los patrones generados por una cuerda que vibra a diferentes frecuencias, pero fijados en ambos extremos. La animación muestra dos “longitudes de onda” entre los extremos, correspondientes al 4to patrón de la parte inferior en la figura de la izquierda.
|
Ondas estacionadas en una cuerda
|
Animación de onda estacionaria gif [chemwiki.ucdavis.edu] |
Pero algunas frecuencias no están permitidas (¡no queremos que la guitarra toque todos los tonos a la vez!). Ocurre en situaciones como esta:
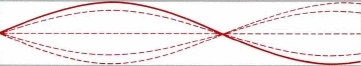
Este modelo encaja con el comportamiento contradictorio de los electrones en los átomos. Específicamente, los electrones parecen existir en ciertas regiones del espacio, pero nunca en regiones entre ellas. Además, los electrones existen en una serie de ondas discretas “orbitales” de energía creciente. La energía aumenta a medida que aumenta el número de nodos. Entonces, el patrón de onda estacionaria va de un nodo a dos nodos, por ejemplo, y no puede existir en ningún lugar intermedio. ¡Ese es exactamente el comportamiento que encontramos para los electrones en las conchas! . Los electrones no existen en ninguna parte entre las conchas. Así, una onda estacionaria puede correlacionarse con la densidad de electrones en los “orbitales” de un átomo, como se muestra en la siguiente figura. Así como la cuerda vibratoria no tiene una posición fija en los antinodos, es imposible especificar la posición (o movimiento exacto) de los electrones restringidos a un núcleo.
Aquí se muestran videos de otra onda estacionaria.
Longitud de onda y frecuencia de las ondas de luz
Las ondas también se utilizan como modelo para la luz, así que definamos la longitud de onda y la frecuencia de una onda con un poco más precisión. Al mover una cuerda, una onda viajera se mueve hacia abajo; si haces esto continuamente, digamos una vez por segundo, generas un tren de ondas itinerantes con una frecuencia de 1 s -1, o una longitud de onda por segundo, donde la longitud de onda es la distancia entre picos sucesivos (o cualquier otra característica repetitiva) de la onda:
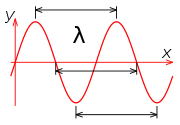
Existe una relación entre la frecuencia, generalmente denotada “ν” (“nu”), la longitud de onda, generalmente denotada “λ” (lambda) y la velocidad que la onda se mueve hacia abajo por la cuerda (o a través del espacio, si es una onda de luz). Si denotamos la velocidad “c” (un símbolo utilizado para la velocidad de la luz), la relación es:
-
- \(\lambda =\tfrac{c}{\nu} \tag{1}\)
Calcular la longitud de onda de un microondas en un horno microondas que viaja a la velocidad de la luz, c = 3.0 x 10 8 m s -1> y tiene una frecuencia de 2.45 GHz (2.45 x 10 9 s -1. de 12.24 cm.
Solución: Reordenando (1) tenemos:
-
- \(\nu =\tfrac{c}{\lambda} = \tfrac{\text{3.0}\times \text{10}^{\text{8}}\text{m s}^{\text{-1}}}{\text{2.45}\times\text{10}^{9}\text{s}^{\text{-1}}} = 0.1224 \text{ m or 2.24 cm }\)
Las microondas son ondas como ondas de luz u ondas de radio, pero su longitud de onda es mucho más larga que la luz, y más corta que la radio. Las ondas de esta longitud de onda interactúan con las moléculas de agua hacen que las moléculas giren más rápido y, por lo tanto, calientan los alimentos
Desarrollo Histórico
Al mismo tiempo que Lewis desarrollaba sus teorías sobre la estructura electrónica, el físico Niels Bohr estaba desarrollando una imagen similar, pero más detallada, del átomo.
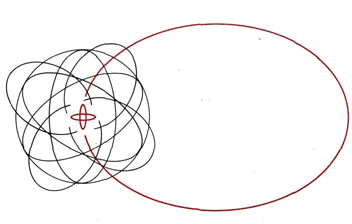
Dado que Bohr estaba interesado en la luz (energía) emitida por los átomos bajo ciertas circunstancias más que en la valencia de los elementos, particularmente quería poder calcular las energías de los electrones. Para ello, necesitaba conocer el camino exacto seguido por cada electrón a medida que se movía alrededor del núcleo. Asumió caminos similares a los de los planetas alrededor del sol. La figura aquí vista, tomada de un texto de física de la época, ilustra las teorías de Bohr aplicadas al átomo de sodio. Observe cómo el modelo de Bohr, como el de Lewis, asume una estructura de concha. Hay dos electrones en la capa más interna, ocho electrones en la siguiente capa y un solo electrón en la capa más externa.
Al igual que el modelo de Lewis's, el modelo de Bohr solo tuvo éxito parcial. Explicó algunos resultados experimentales pero fue bastante incapaz de dar cuenta de otros. En particular falló en el nivel matemático cuantitativo. La teoría de Bohr funcionó muy bien para un átomo de hidrógeno con su solo electrón, pero los cálculos sobre átomos con más de un electrón siempre dieron la respuesta equivocada. A nivel químico, también, ciertas características fueron inadecuadas. No hay evidencia que sugiera que los átomos de sodio sean siempre tan alargados o planos como el de la figura. Por el contrario, la forma en que los átomos de sodio se agrupan en un sólido sugiere que se extienden uniformemente en todas las direcciones; es decir, son de forma esférica. Otra debilidad en la teoría era que tenía que asumir una estructura de caparazón en lugar de explicarla. Después de todo, no hay nada en la naturaleza de los planetas que se mueven alrededor del sol que los obligue a orbitar en grupos de dos u ocho. Bohr asumió que los electrones se comportan de manera muy parecida a los planetas; entonces, ¿por qué deberían formar conchas de esta manera?
Energía de la Luz
Por lo general, pensamos en las conchas de electrones en términos de su energía. Eso se debe a que la energía luminosa se emite cuando un electrón cae de un caparazón superior a uno inferior, y medir la energía lumínica es la forma más importante de determinar la diferencia de energía entre las conchas. Cuando los electrones cambian de nivel, emiten cuantos de luz llamados “fotones”). La energía de un fotón está directamente relacionada con su frecuencia, o inversamente relacionada con la longitud de onda:
-
- \(\text{E} = \text {h} \times \nu =\frac{\text{h}\times\text{c}}{\lambda} \tag{2} \)
La constante de proporcionalidad h se conoce como constante de Planck y tiene el valor 6.626 × 10 —34 J s. La luz de mayor frecuencia tiene mayor energía, una longitud de onda más corta.
La luz solo puede ser absorbida por los átomos si cada fotón tiene exactamente la cantidad correcta de energía para promover un electrón de una capa inferior a una superior. Si se requiere más energía de la que posee un fotón, no se puede suministrar bombardeando el átomo con más fotones. Por lo que frecuentemente encontramos que la luz de una longitud de onda provocará un cambio fotoquímico por tenue que sea, mientras que la luz de una longitud de onda vecina no provocará un cambio fotoquímico por muy intensa que sea. Eso es porque los fotones deben ser absorbidos para provocar un cambio fotoquímico, y deben tener exactamente la energía necesaria para ser promovidos al siguiente caparazón para ser absorbidos. Si no son absorbidos, no importa cuán intensa sea la luz (cuántos fotones hay por segundo).
¿Qué longitud de onda de luz es emitida por un átomo de hidrógeno cuando un electrón cae de la tercera concha, donde tiene E = -2.42088863 × 10 - 19 J, a la segunda concha, donde tiene E = -5.44739997 × 10 -19 J?
Solución: ΔE = E 2 - E 1 = (-5.45 × 10 -19) - (-2.42 × 10 - 19 J) = -3.03 × 10 - 19 J. Obsérvese que los niveles de energía se vuelven más negativos (se libera más energía cuando un electrón cae en ellos) cerca del núcleo, y la diferencia aquí es negativa, es decir, se libera energía. Tomando el valor absoluto de la energía para calcular la energía del fotón, y la ecuación de rearraning (2):
-
- \(\lambda =\frac{\text{h}\times\text{c}}{E}\)
- λ = [(6.626 × 10 —34 J s) (3 x 10 8)]/3.03 × 10 - 19 J = 6.56 x 10 -7 m o 656 nm, la longitud de onda de la luz roja.
Ondas estacionarias bidimensionales
Por supuesto, las conchas para electrones son tridimensionales, no unidimensionales como las cuerdas de guitarra. Podemos comenzar a visualizar ondas estacionarias en más de una dimensión pensando en patrones de onda en una piel de tambor en dos dimensiones. Algunos de los patrones de onda se muestran a continuación. Si miras cuidadosamente, verás nodos circulares que no se mueven:
|
Modo vibración tambor 01 gif [chemwiki.ucdavis.edu] |
Modo de vibración de tambor 02 [chemwiki.ucdavis.edu] |
Modo vibración tambor 03 gif [chemwiki.ucdavis.edu] |
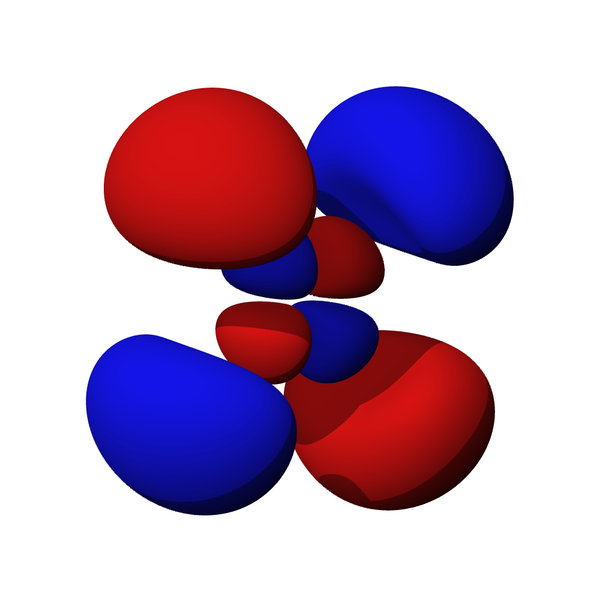
La forma de los orbitales
Los electrones existen alrededor del núcleo en “orbitales”, que son ondas estacionarias tridimensionales. Las ondas estacionarias de electrones son bastante hermosas, y veremos más de ellas en las próximas secciones. Un ejemplo es la flor como “f orbital” a continuación. Aquí las partes rojas de la “función de onda” representan partes matemáticamente positivas (hacia arriba) de la onda estacionaria, mientras que las partes azules son partes matemáticamente negativas (hacia abajo):
Referencias
- es.wikipedia.org/wiki/Archivo:cl... is_at_wall.gif


