5.6: El principio de incertidumbre
- Page ID
- 75450
Nuestra incapacidad para localizar exactamente un electrón puede parecer bastante extraña, pero surge tanto si pensamos en términos de ondas como de partículas. Supongamos que se va a hacer un experimento para localizar una bola de billar que se mueve a través de una mesa de billar cuya superficie está oculta bajo una tela negra.
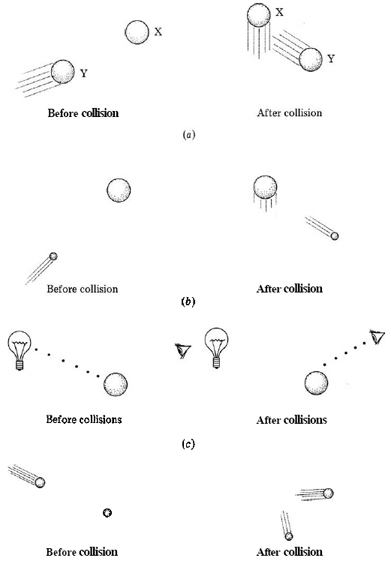
Una forma de hacerlo sería intentar rebotar una segunda bola de billar de la primera (Figura\(\PageIndex{1}\). Cuando se hizo un golpe y la segunda bola emergió de debajo de la tela, tendríamos una idea bastante buena de dónde estaba la primera pelota. El único problema con el experimento es que la posición y la velocidad de la primera pelota casi con toda seguridad serían cambiadas por la colisión. Para disminuir este efecto, una pelota de tenis de mesa podría ser sustituida por la segunda pelota de billar; su masa más pequeña produciría un cambio mucho menor en el movimiento de la primera pelota. Claramente, cuanto más ligera y delicada sea la “sonda” que utilizamos para tratar de localizar la primera bola, menos le afectará nuestra medición. La mejor manera de localizar la primera bola de billar y determinar su velocidad sería quitando la tapa de la mesa para que se pudiera ver. En este caso, sin embargo, algo sigue “rebotando” en la primera bola de billar (Figura 1 c). Si vamos a ver la pelota, partículas de luz visible, o fotones, deben golpear la pelota y reflejarse ante nuestros ojos. Dado que cada fotón es muy pequeño y tiene muy poca energía en comparación con la necesaria para cambiar el movimiento de la bola de billar, mirar una pelota es un excelente medio de observarla sin cambiar su posición o velocidad.
Pero observar un electrón es otra historia muy distinta, ya que la masa de un electrón es mucho menor que la de una bola de billar. Cualquier cosa (como un fotón de luz) que pueda rebotar en un electrón de tal manera que lo localice con precisión tendría mucha más energía de la que se requeriría para cambiar la trayectoria del electrón. De ahí que sería imposible predecir la velocidad o posición futura del electrón a partir del experimento. La idea de que es imposible determinar con precisión tanto la ubicación como la velocidad de cualquier partícula tan pequeña como un electrón se llama el principio de incertidumbre. Fue propuesto por primera vez en 1927 por Werner Heisenberg (1901 a 1976).
Según el principio de incertidumbre, aunque dibujemos una analogía entre el electrón en una caja y una bola de billar (Figura 1 a en Mecánica de Ondas), será imposible determinar tanto la posición exacta del electrón en la caja como su velocidad exacta. Dado que la energía cinética depende de la velocidad (½ mu 2) y la ecuación (4) en Mecánica de Ondas asigna valores exactos de energía cinética al electrón en la caja, la velocidad se puede calcular con precisión. Esto significa que la determinación de la posición del electrón será muy inexacta.
El principio de incertidumbre de Heisenberg se afirma matemáticamente como
\[\Delta X \Delta P \ge \frac{\hbar}{2} \nonumber \]
donde\(ΔX\) está la incertidumbre en la posición, ΔP es la incertidumbre en el impulso, y\(\hbar\) es la Constante de Planck dividida por\(2π\).
Se podrá hablar de la probabilidad de que el electrón se encuentre en una ubicación específica, pero también habrá alguna probabilidad de encontrarlo en otro lugar de la caja. Ya que es imposible saber con precisión dónde está el electrón en un instante dado, la pregunta: “¿Cómo llega de un lugar a otro?” no tiene sentido. ¡Hay una probabilidad finita de que estuviera en el otro lugar para empezar!
Sin embargo, es posible ser cuantitativo sobre la probabilidad de encontrar un electrón de “bola de billar” en una ubicación determinada. Poco después de que se propusiera el principio de incertidumbre, el físico alemán Max Born (1882 a 1969) sugirió que la intensidad de la onda electrónica en cualquier posición de la caja era proporcional a la probabilidad de encontrar el electrón (como partícula) en esa misma posición. Así, si podemos determinar las formas de las ondas que se van a asociar a un electrón, también podemos determinar la probabilidad relativa de que se ubique en un punto opuesto a otro. Los modelos de onda y partículas para el electrón están así conectados y se refuerzan entre sí. Niels Bohr sugirió el término complementario para describir su relación. No sirve de nada preguntar: “¿El electrón es una onda o una partícula?” Ambas son formas de dibujar una analogía entre el mundo microscópico y las cosas macroscópicas cuyo comportamiento entendemos. Ambos son útiles en nuestro pensamiento, y son complementarios más que mutuamente excluyentes.
Una forma gráfica de indicar la probabilidad de encontrar el electrón en una ubicación particular es por la densidad de sombreado o punteado a lo largo de la caja. Esto se ha hecho en la Figura 2 para las mismas tres ondas de electrones previamente ilustradas en la Figura 1 de Mecánica de Ondas. Observe que la densidad de puntos es grande dondequiera que la onda electrónica sea grande. (Esto correspondería en la analogía de guitarra-cuerda a lugares donde la cuerda vibraba bastante lejos de su posición de reposo).
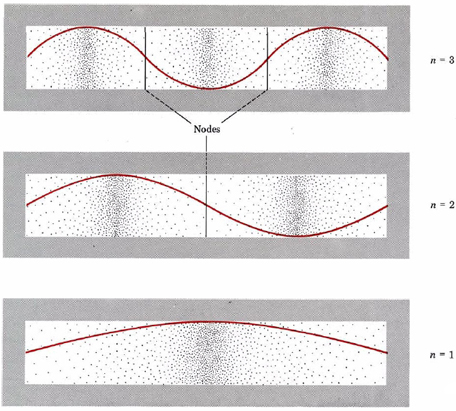
Donde la onda electrónica es pequeña (cerca de los extremos de la caja en los tres casos y en los nodos indicados en la figura), solo hay un pequeño número de puntos. (Un nodo es un lugar donde la intensidad de la onda es cero, es decir, en la analogía de guitarra-cuerda, donde la cuerda no se ha movido desde su posición de reposo).
Si se piensa que el electrón es una onda que ocupa todas las partes de la caja a la vez, podemos hablar de una nube de electrones que tiene mayor o menor densidad en diversas partes de la caja. Habrá una mayor cantidad de carga negativa en una región de alta densidad (una región donde hay una mayor concentración de puntos) que en una de baja densidad. En un átomo o molécula, según el principio de incertidumbre, lo mejor que podemos hacer es indicar la densidad de electrones en varias regiones; no podemos localizar la posición precisa del electrón. Por lo tanto, los diagramas de densidad de puntos de electrones, como los que se muestran en la Figura 2, dan una imagen realista y útil del comportamiento de los electrones en átomos. En dicho diagrama la densidad electrónica o probabilidad de encontrar el electrón se indica por el número de puntos por unidad de área. Encontraremos diagramas de densidad de puntos de electrones con bastante frecuencia a lo largo de este libro. Todos estos han sido generados por una computadora a partir de descripciones matemáticas precisas del átomo o molécula en discusión.


