5.7: Ondas de electrones en el átomo de hidrógeno
- Page ID
- 75465
Un electrón en un átomo difiere en dos formas del electrón hipotético en una caja. Primero, en un átomo el electrón ocupa las tres dimensiones del espacio ordinario. Esto permite que las formas de las ondas de electrones sean más complicadas. Segundo, el electrón no está confinado en un átomo por las paredes sólidas de una caja. En cambio, la fuerza electrostática de atracción entre el núcleo positivo y el electrón negativo impide que este último escape.
En 1926 Erwin Schrödinger (1887 a 1961) ideó un procedimiento matemático mediante el cual se podían obtener las ondas y energías de electrones para esta situación más complicada. Una solución de la ecuación de onda de Schrödinger está más allá del alcance de un texto de química general. Sin embargo, muchos fenómenos químicos se pueden entender mejor si uno está familiarizado con los resultados de Schrödinger, y los consideraremos con cierto detalle.
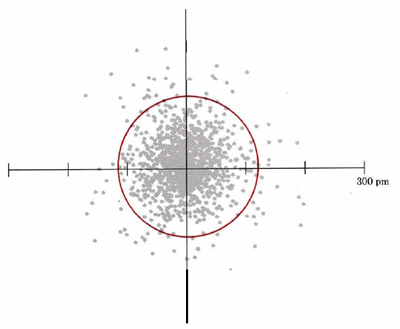
La distribución de la densidad electrónica predicha por la solución de la ecuación de Schrödinger para un átomo de hidrógeno que tiene la mínima cantidad posible de energía se ilustra en la Figura 1. A partir de esta figura se pueden observar una serie de características generales del comportamiento de los electrones en átomos y moléculas.
En primer lugar, el átomo de hidrógeno no tiene un límite bien definido. El número de puntos por unidad de área es mayor cerca del núcleo del átomo en el centro del diagrama (donde se cruzan los dos ejes). La densidad de electrones disminuye a medida que aumenta la distancia desde el núcleo, pero hay algunos puntos a distancias tan grandes como 200pm (2.00 Å) del centro. Así, a medida que uno se acerca cada vez más al núcleo de un átomo, la densidad de electrones se acumula lenta y constantemente de un valor muy pequeño a uno grande. Otra forma de afirmar lo mismo es decir que la nube de electrones se vuelve más densa a medida que se acerca al centro del átomo.
Una segunda característica evidente de la Figura 1 es la forma de la nube de electrones. En este diagrama bidimensional parece ser aproximadamente circular; en tres dimensiones sería esférico (Figura 2). La siguiente imagen es un diagrama tridimensional de densidad de puntos para el orbital del átomo de hidrógeno mostrado en la Figura 1. Este orbital de menor energía, llamado orbital 1s, aparece esféricamente simétrico. En dos dimensiones, esto se puede ilustrar más fácilmente dibujando un círculo (o en tres dimensiones, una esfera) que contenga un gran porcentaje (digamos 75 o 90 por ciento) de los puntos, como se ha hecho en la figura anterior. Dado que tal esfera o círculo encierra la mayor parte (pero no toda) la densidad electrónica, está casi lo más cerca que se puede llegar a trazar un límite que encierra al átomo. Los diagramas de superficie límite en dos y tres dimensiones son más fáciles de dibujar rápidamente que los diagramas de densidad de puntos. Por lo tanto los químicos los usan mucho.