5.16: Configuraciones de electrones
- Page ID
- 75381
Para examinar los resultados de la teoría de ondas del electrón para cada elemento en la tabla periódica, debemos recordar las reglas generales que son necesarias para predecir configuraciones de electrones para todos los átomos de los elementos. Para su revisión, estas reglas son las siguientes:
- 1 El principio Aufbauprinciple (principio de acumulación). La estructura de un átomo puede construirse a partir de la del elemento que lo precede en el sistema periódico añadiendo un protón (y un número apropiado de neutrones) al núcleo y un electrón extranuclear.
- 2 El orden de llenado de orbitales. Cada vez que se agrega un electrón, ocupa la subcapa disponible de menor energía. La cubierta apropiada se puede determinar a partir de un diagrama como la Figura\(\PageIndex{1}\) a que dispone las subconchas en orden de aumento de energía. Una vez que una subcapa se llena, la subcapa de la siguiente energía superior comienza a llenarse.
- 3 El principio de exclusión Pauli. No más de dos electrones pueden ocupar un solo orbital. Cuando dos electrones ocupan el mismo orbital, deben ser de espín opuesto (un par de electrones).
- 4 Regla de Hund. Cuando los electrones se agregan a una subcapa donde hay más de un orbital de la misma energía disponible, sus espines permanecen paralelos y ocupan orbitales diferentes. El apareamiento de electrones no ocurre hasta que es requerido por la falta de otro orbital vacío en la subcapa.
El orden en que se llenan las subcáscaras merece alguna discusión. Como se puede ver en la Figura\(\PageIndex{1}\) a dentro de un shell dado las energías de las subcapas aumentan en el orden s < p < d < f.
Cuando discutimos el átomo de boro, vimos que un orbital p es mayor en energía que el orbital s en la misma concha porque el orbital p es más efectivamente tamizado desde el núcleo. Razonamiento similar explica por qué d orbitales son más altos en energía que p orbitales pero menores que f orbitales.
No sólo las energías de un caparazón dado se extienden de esta manera, sino que a veces hay un solapamiento en la energía entre los proyectiles. Como puede verse en la Figura\(\PageIndex{1}\) a la subcapa de mayor energía en la tercera concha, a saber, 3 d, está por encima de la subcapa de menor energía en la cuarta concha, a saber, 4 s.
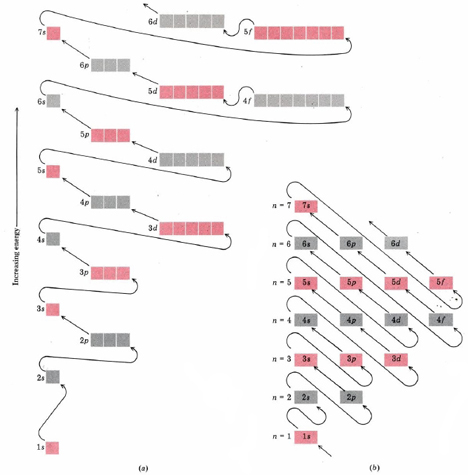
Se producen superposiciones similares entre los subproyectiles del cuarto, quinto, sexto y séptimo proyectiles. Estos causan excepciones al orden esperado de llenado de subcarcasas. El orbital de 6 s, por ejemplo, comienza a llenarse antes del 4 f.
Si bien el orden en que se llenan las subconchas parece irremediablemente complejo a primera vista, existe un dispositivo muy simple disponible para recordarlo.
Esto se muestra en la Figura\(\PageIndex{1}\) b. Las filas de esta tabla constan de todos los subshells posibles dentro de cada shell. Por ejemplo, la segunda fila de la parte inferior contiene 2 s y 2 p, los dos subshells en el segundo caparazón. La inserción de líneas diagonales de la manera mostrada da el orden correcto para llenar las subcarcasas.
Predecir la configuración electrónica para cada uno de los siguientes átomos:
a)\({}_{\text{15}}^{\text{31}}\text{P}\); b)\({}_{\text{27}}^{\text{59}}\text{Co}\).
Solución
En cada caso seguimos las reglas que acabamos de enunciar.
a) Porque\({}_{\text{15}}^{\text{31}}\text{P}\) habría 15 protones y 16 neutrones en el núcleo y 15 electrones extra nucleares. Usando la Figura 1 b para predecir el orden en que se llenan los orbitales, tenemos
1 s 2 2 electrones, dejando 15 — 2 = 13 más para agregar2 s 2 2 electrones, dejando 11 más para agregar
2 p 2 x, 2 p 2 y, 2 p 2 z, (o 2 p 6) 6 electrones, dejando 5 más para sumar
3 s 2 2 electrones, dejando 3 más para agregar
3 p 1 x, 3 p 1 y, 3 p 1 z 3 electrones
La configuración electrónica es así\({}_{\text{15}}^{\text{31}}\text{P}\) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 x 3 p 1 y 3 p 1 z También podría escribirse [Ne] 3 s 2 3 p 1 x 3 p 1 y 3 p 1 z o [Ne] 3 s 2 3 p 3 o donde [Ne] representa el núcleo de neón 1 s 2 2 s 2 2 p 6. b) En el caso del cobalto hay un total de 27 electrones para llenar en los orbitales. No hay dificultad con los primeros 10 electrones. Al igual que en el ejemplo anterior, llenan el primer y segundo caparazón: 1 s 2 2 s 2 p 6 17 más para agregar El tercer caparazón ahora comienza a llenarse. Primero la subcapa 3 s luego la subcapa 3 p se llenan por 8 electrones más: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 9 más para sumar Dado que esta es también la estructura de argón, podemos usar la forma abreviada[Ar] 9 más para agregar
Llegamos ahora a una superposición de energía entre el tercer y cuarto proyectiles. Debido a que los orbitales de 3 d están tan bien protegidos del núcleo, son más altos en energía que los orbitales de 4 s. En consecuencia, los siguientes orbitales a llenar son los orbitales de 4 s:
-
- [Ar] 4 s 2 7 más para agregar
Una vez que se llena la órbita de 4 s, los orbitales 3d son los siguientes en la línea para ser llenados. Los 7 electrones restantes son insuficientes para llenar esta subcapa para que tengamos el resultado final
-
- [Ar] 3 d 7 4 s 2
Las configuraciones de electrones de los átomos se pueden determinar experimentalmente. El Cuadro 1 en Configuraciones de Electrones y la Tabla Periódica enumera los resultados que se han obtenido. Existen algunas excepciones a las cuatro reglas enunciadas anteriormente, pero suelen ser relativamente menores. Un ejemplo obvio de tal excepción es la estructura del cromo. Se encuentra que es [Ar] 3 d 5 4 s 1, mientras que nuestras reglas habrían predicho [Ar] 3 d 4 4 s 2. El cromo adopta esta estructura porque permite que los electrones se eviten entre sí de manera más efectiva. Una discusión completa de esta y otras excepciones está fuera del alcance de un texto introductorio.


