5.15: Berilio, Boro, Carbono
- Page ID
- 75505
Berilio
Como se muestra a continuación, hay dos electrones de 1 s y dos electrones de 2 s en el átomo Be. Su configuración electrónica es así
\[1s^{2}2s^{2} \ce{or [He]}2s^{2} \nonumber \]
El símbolo [Él] denota la capa interna de dos electrones de 1 s que tienen la misma configuración que el gas noble He.
El átomo de berilio es notablemente más pequeño que el átomo de litio. Esto se debe al incremento de la carga nuclear de +3 a +4. Dado que los dos electrones externos de 2 s (rojo y naranja) a menudo no se interponen entre sí y el núcleo, no se proyectan muy bien entre sí desde el núcleo. Sólo los dos electrones internos son efectivos en este sentido. La carga nuclear efectiva que contiene un electrón de 2 s en el núcleo es así casi +2, aproximadamente el doble del valor para el litio, y las nubes de electrones de 2 s se acercan al centro del átomo.
Boro
El siguiente elemento después del berilio es el boro. Dado que el orbital de 2 s está completamente lleno, se debe usar un nuevo tipo de orbital para el quinto electrón. Hay tres orbitales de 2 p disponibles, y cualquiera de ellos podría ser utilizado. La placa 5 muestra el quinto electrón (púrpura codificado por colores) ocupando el orbital 2p x. Observe cuidadosamente las diferencias entre las distribuciones de densidad electrónica de 2p x y 2 s en el átomo de boro. Aunque en promedio ambas nubes de electrones se extienden aproximadamente a la misma distancia del núcleo, la onda de 2p x electrón tiene un nodo que pasa por el centro del átomo. Así, la nube de electrones 2p x tiene una densidad de probabilidad mucho menor muy cercana al núcleo que una nube de 2 s. Esto significa que la nube de electrones 2p x es más efectivamente tamizada por los electrones de 1 s de la carga nuclear. El átomo ejerce una atracción general ligeramente menor sobre el electrón 2 p que sobre el electrón de 2 s. La presencia de los electrones internos tiene así el efecto de hacer que el orbital de 2 p sea algo más alto en energía que el orbital de 2 s.
Esta diferencia de energía entre 2 s y 2 p electrones en el átomo de boro es un ejemplo de un comportamiento más general. En cualquier átomo con suficientes electrones siempre encontramos que un orbital p es algo mayor en energía que un orbital s con el mismo valor de n. En el átomo de litio, por ejemplo, el tercer electrón ocupa un orbital de 2 s en lugar de un 2 p porque esto le da una energía algo menor. Más adelante en la tabla periódica encontraremos una diferencia similar entre orbitales de 3 s y 3 p y entre orbitales de 4 s y 4 p.
Carbono
Examinaremos la configuración electrónica de un átomo más, el carbono, con la ayuda de los diagramas codificados por colores. En este caso deben distribuirse seis electrones entre los orbitales, cuatro se emparejarán en los orbitales de 1 s y 2 s, dejando dos nubes de electrones tipo p. Estos se muestran codificados por colores púrpura y cian en la Placa 5 como 2p x y 2p y, aunque la elección de las direcciones x, y o z es arbitraria. Sin embargo, la elección de dos orbitales p diferentes no es arbitraria. Se puede demostrar experimentalmente que ambos electrones p en el átomo de carbono tienen el mismo giro. De ahí que no puedan ocupar la misma órbita.
Esto ilustra otra regla general con respecto a las configuraciones de electrones. Cuando se dispone de varios orbitales del tipo came pero de diferente orientación, los electrones los ocupan uno a la vez, manteniendo los espines paralelos, hasta que se ven obligados a emparejarse por falta de orbitales vacíos adicionales. Esto se conoce como regla de Hund. Así, la configuración electrónica del carbono es
\[\ce{[He]}2s^{2} 2p_{x}^{1} 2p_{y}^{1} \nonumber \]
Esto también podría escribirse (usando flechas para indicar las orientaciones de los espines electrónicos):
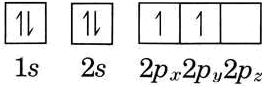
También se\(\ce{[He]}2s^{2}2p^{2}\) puede encontrar la notación. En tal caso se supone que el lector sabe que los dos electrones de 2 p no están emparejados por espín.
Cabe señalar que la disposición de los electrones en diferentes orbitales de 2 p, necesarios por la regla de Hund, produce una configuración de menor energía. Si ambos electrones de 2 p pudieran ocupar el mismo orbital, digamos el orbital 2p x, a menudo estarían cerca uno del otro, y su repulsión mutua correspondería a una energía potencial mayor. Sin embargo, si cada uno se ve obligado a ocupar un orbital de diferente orientación, los electrones se mantienen alejados unos de otros de manera mucho más efectiva. Su repulsión mutua y de ahí su energía potencial es menor.
Al hablar de átomos polielectrónicos, a menudo se utilizan los términos shell y subshell. Cuando los dos electrones tienen el mismo número cuántico principal, se dice que pertenecen a la misma cáscara. En el átomo de carbono, por ejemplo, los dos electrones de 2 s y los electrones 2p x y 2p y pertenecen todos a la segunda capa, mientras que los dos electrones de 1 s pertenecen a la primera capa. Las conchas definidas de esta manera se pueden dividir en subconchas según si los electrones que se discuten ocupan orbitales s, p, d o f. Así podemos dividir el segundo caparazón en 2 s y 2 p subconchas. El tercer caparazón se puede dividir de manera similar en subcapas de 3 s, 3 p y 3 d, y así sucesivamente.


