6.7: Ionización de elementos de transición y transición interna
- Page ID
- 75760
En la gráfica de las energías de ionización, se puede observar que las energías de ionización aumentan mucho más lentamente a través de los elementos de transición y transición interna que para los elementos representativos. Por ejemplo, la energía de ionización del elemento representativo boro es de 800 kJ mol —1. Cinco elementos más tarde encontramos neón, cuya energía de ionización es de 2080 kJ mol —1, un incremento de 160 por ciento. En el cuarto periodo, el elemento de transición escandio tiene una energía de ionización de 631 kJ mol —1. Cinco elementos más tarde encontramos hierro a 759 kJ mol —1, un incremento de sólo 20 por ciento. Todos los lantanoides tienen energías de ionización de 500 a 600 kJ mol —1, y los actinoides están todos entre 580 y 680 kJ mol —1.
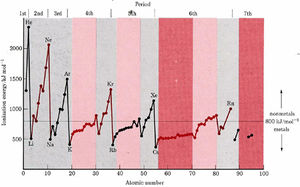
Estas similitudes entre la transición y especialmente los elementos de transición interna ilustran declaraciones hechas sobre configuraciones de electrones y la tabla periódica. El electrón distintivo para un elemento de transición ingresa a una subcapa d en la capa próxima a la más externa, mientras que para un elemento de transición interior generalmente ingresa a una subcapa f en la capa tercera desde la más externa.
Así, la distinción entre un elemento y el que lo precede en la tabla periódica es mucho menor que entre los elementos representativos. Además, las mediciones experimentales muestran que para los elementos de transición y transición interna los electrones perdidos cuando ocurre la ionización no son los últimos que se agregaron para construir la configuración de electrones atómicos. En cambio, los electrones generalmente se eliminan primero de la subcapa que tiene el mayor número cuántico principal.
Ejemplo 6.7.1 : Configuración de electrones
Determinar la configuración electrónica del ion Fe 3 +.
Solución
Dado que la carga en el ion es +3, tres electrones deben haber sido removidos de un átomo de hierro neutro (Fe). La configuración electrónica del Fe es
Fe: ... 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 4 s 2 o [Ar] 3 d 6 4 s 2
Ahora eliminamos electrones sucesivamente de las subconchas que tienen el mayor número cuántico principal:
Fe +: [Ar] 3 d 6 4 s 1 un 4s electrón eliminado
Fe 2 +: [Ar] 3 d 6 un segundo electrón de 4 s eliminado
Fe 3 +: [Ar] 3 d 5 ya que no quedan electrones en el caparazón n = 4, se elimina un electrón de 3 d
El comportamiento descrito en el párrafo anterior y el ejemplo pueden entenderse mejor comparando los shells 3d y 4s, como en la siguiente figura.
_and_4s_(color)_Electron_Clouds.jpg)
Los electrones en la subcapa que tienen el mayor número cuántico principal (4 s en el ejemplo y la figura anterior) están, en promedio, más alejados del núcleo, y son los primeros en ser eliminados. La primera energía de ionización del hierro no es mucho mayor que la del escandio porque en cada caso se está eliminando un electrón de 4 s. El átomo de hierro tiene cinco protones más en el núcleo, pero también tiene cinco electrones más de 3 d que pasan la mayor parte de su tiempo entre el núcleo y los electrones de 4 s. El efecto de cribado de tales electrones de 3 d hace que la carga nuclear efectiva aumente muy lentamente de un elemento de transición al siguiente. La atracción por los electrones de 4 s, y por ende la energía de ionización, también aumenta muy lentamente.
Metales
Las propiedades macroscópicas como alta conductividad térmica y eléctrica, maleabilidad y ductilidad se mencionaron en una breve introducción a los elementos como características de los metales. Además, la mayoría de los metales tienen bajas energías de ionización, generalmente por debajo de 800 kJ mol —1. En otras palabras, un metal consiste en átomos, cada uno de los cuales tiene al menos un electrón holgadamente sostenido.
Cuando tales átomos se empaquetan juntos en un metal sólido, los electrones holgados son relativamente libres para moverse de un átomo a otro. Si los electrones en exceso son forzados a entrar en un extremo de un cable metálico, es relativamente fácil que los electrones fluyan fuera del otro extremo. Por lo tanto, una corriente eléctrica puede ser transportada a través del cable, y se puede entender la alta conductividad de todos los metales.
Posteriormente se dan interpretaciones microscópicas más detalladas de las propiedades metálicas para los Metales, pero por el momento nos interesa principalmente la ubicación de los elementos metálicos en la tabla periódica. Las energías de ionización son más pequeñas cerca de la parte inferior y a la izquierda de la tabla periódica, por lo que aquí es donde se encuentran los metales. Además, las energías de ionización aumentan lentamente de un elemento de transición al siguiente y apenas en absoluto a través de los elementos de transición internos. Por lo tanto, todos los elementos de transición y transición interna son metales.
En los grupos periódicos IIIA, IVA y VA, los elementos cercanos a la parte superior de la mesa tienen grandes energías de ionización y poco carácter metálico. Sin embargo, las energías de ionización disminuyen a medida que se mueve hacia abajo. Por ejemplo, Al es bastante metálico, aunque el elemento por encima de él, B, no lo es. Una línea pesada de “escalera” generalmente se dibuja en la tabla periódica para separar los no metales (arriba y hacia la derecha) de los metales. Elementos como B, Si, Ge, As, Sb y Te, que son adyacentes a la escalera, tienen propiedades intermedias y se denominan semimetales. Esta misma clase también se conoce como metaloides.


