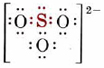7.13: Carga Formal y Números de Oxidación
- Page ID
- 75009
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Cargo Formal
En la página que discute el enlace covalente, se muestra que la densidad de electrones en un enlace covalente es compartida entre ambos átomos. Al dibujar Lewis Structures a veces es útil ver qué estructura puede considerarse la mejor. La Carga Formal es un dispositivo algo artificial que existe en la mente de los químicos (no dentro de las moléculas, en sí mismas) para ayudar a realizar un seguimiento de los electrones en sus configuraciones de unión. La Carga Formal es la carga que tendría un átomo en una molécula o ion poliatómico si todos los electrones de enlace se dividieran equitativamente entre átomos en el enlace.
Aquí hay algunas reglas para determinar la Carga Formal en cada átomo en una molécula o ion poliatómico:
- Los electrones dentro de un Par Solitario sobre un átomo se asignan exclusivamente a ese átomo.
- La mitad de los electrones en cada enlace alrededor de un átomo están asignados a ese átomo.
- Las Cargas Formales en todos los átomos de una molécula deben sumar a cero; para un ion poliatómico las Cargas Formales deben sumarse a la carga sobre el ión (que puede ser positiva o negativa).
El Cargo Formal se define por la relación:
Carga formal = [número de electrones de valencia en un átomo aislado] - [(número de electrones de par solitario) + ½ (número de electrones de enlace)]
Con las definiciones anteriores, podemos calcular la Carga Formal sobre el Ion tiocianato, SCN -:
 |
S | C | N |
|---|---|---|---|
| Electrones de valencia | 6 | 4 | 5 |
| Electrones de par solitario | 6 | 0 | 2 |
| Electrones compartidos (enlaces) | 2 (1) | 8 (4) | 6 (3) |
| Cargo Formal = | 6 - (6 + ½·2) | 4 - (0 + ½·8) | 5 - (2 + ½·6) |
| Cargo Formal | -1 | 0 | 0 |
Observe cómo la suma de todos los cargos formales se suma a la carga del ion tiocianato (-1). Al dibujar Lewis Structures, utilizamos esta información para determinar qué estructura sería la más probable. Se aplican las siguientes reglas:
- Los Cargos Formales absolutos más pequeños son más favorables (recordemos que el valor absoluto de un número es > 0)
- Las Cargas Formales Negativas deben estar en los átomos más electronegativos
- Cargas similares no deben estar en átomos adyacentes
Números de oxidación
También hemos discutido la electronegatividad, que da lugar a polaridad en enlaces y moléculas. Así, a veces nos sirve definir otro dispositivo algo artificial -inventado por químicos, no por moléculas- que nos permite realizar un seguimiento de los electrones en reacciones complicadas donde los electrones se reordenan en nuevos enlaces.
Podemos obtener números de oxidación asignando arbitrariamente los electrones de cada enlace covalente al átomo más electronegativo del enlace. Esto contrasta con la Carga Formal que divide cada par de unión por igual sin preocuparse por qué átomo puede ser más electronegativo. Cuando se ha hecho esta división para todos los enlaces, se dice que la carga que queda en cada átomo es su número de oxidación. Si se unen dos átomos similares, a cada átomo se le asigna la mitad de los electrones de enlace.
Determinar el número de oxidación de cada átomo en cada una de las siguientes fórmulas: (a) Cl 2; (b) CH 4; (c) NaCl; (d) DE 2; (e) H 2 O 2.
Solución:
En cada caso comenzamos dibujando un diagrama de Lewis:

En cada diagrama de Lewis, los electrones han sido codificados por colores para indicar el átomo del que vinieron originalmente. Las cajas encierran electrones asignados a un átomo dado por las reglas para determinar el número de oxidación.
a) Dado que el enlace en Cl 2 es puramente covalente y los electrones se comparten por igual, se asigna un electrón del enlace a cada Cl, dando el mismo número de electrones de valencia (7) que un átomo de Cl neutro. Por lo tanto, ninguno de los átomos ha perdido electrones, y el número de oxidación es 0. Esto se indica escribiendo un 0 encima del símbolo para cloro en la fórmula
\[\overset{0}{\mathop{\text{Cl}}}\,_{\text{2}} \nonumber \]
b) Dado que C es más electronegativo que H, el par de electrones en cada enlace C—H se asigna a C. Por lo tanto, cada H ha perdido el único electrón de valencia que originalmente tenía, dando un número de oxidación de +1. El átomo C ha ganado cuatro electrones, dándole una carga negativa y por lo tanto un número de oxidación de — 4:
\[\overset{-\text{4}}{\mathop{\text{C}}}\,\overset{\text{+1}}{\mathop{\text{H}}}\,_{\text{4}} \nonumber \]
c) En NaCl cada átomo de Na ha perdido un electrón para formar un ion Na +, y cada átomo de Cl ha ganado un electrón para formar Cl —. Por lo tanto, los números de oxidación corresponden a las cargas iónicas:
\[\overset{\text{+1}}{\mathop{\text{Na}}}\,\overset{-\text{1}}{\mathop{\text{Cl}}}\, \nonumber \]
d) Dado que F es más electronegativo que O, los pares de unión se asignan a F en difluoruro de oxígeno (DE 2). El O se deja con cuatro electrones de valencia, y cada F tiene ocho. Los números de oxidación son
\[\overset{\text{+2}}{\mathop{\text{O}}}\,\overset{-\text{1}}{\mathop{\text{F}_{\text{2}}}}\, \nonumber \]
e) En el peróxido de hidrógeno (H 2 O 2) los pares de enlaces O-H se asignan a las O más electronegativas, pero el enlace O—O es puramente covalente, y el par de electrones se divide por igual. Esto le da a cada O siete electrones, una ganancia de 1 sobre el átomo neutro. Los números de oxidación son
\[\overset{\text{+1}}{\mathop{\text{H}_{\text{2}}}}\,\overset{-\text{1}}{\mathop{\text{O}_{\text{2}}}}\, \nonumber \]
Aunque siempre se podrían elaborar diagramas de Lewis para obtener números de oxidación como se muestra en Ejemplo\(\PageIndex{1}\), a menudo es más fácil usar algunas reglas simples para obtenerlos. Las reglas resumen las propiedades de los números de oxidación ilustrados en Ejemplo\(\PageIndex{2}\).
- El número de oxidación de un átomo en un elemento no combinado es 0. Dado que los átomos del mismo elemento siempre forman enlaces covalentes puros, comparten electrones por igual, sin perder ni ganar, e.g., Cl 2.
- El número de oxidación de un ion monoatómico es igual a la carga en ese ion, por ejemplo, Na + y Cl —.
- Algunos elementos tienen el mismo número de oxidación en casi todos sus compuestos.
- Los elementos del grupo periódico IA tienen números de oxidación de +1, y los elementos del grupo periódico IIA tienen números de oxidación de +2, por ejemplo, Na +.
- Al elemento más electronegativo, el flúor, siempre se le asignan ambos electrones de cualquier enlace en el que participe. Esto le da al flúor un número de oxidación de —1 en todos sus compuestos, por ejemplo, DE 2.
- El oxígeno suele exhibir un número de oxidación de —2, pero las excepciones ocurren en peróxidos, superóxidos y cuando el oxígeno se combina con flúor.
- El hidrógeno exhibe un número de oxidación de +1 a menos que se combine con un elemento más electropositivo que él mismo, por ejemplo, con litio, en cuyo caso su número de oxidación es —1.
- La suma de los números de oxidación de todos los átomos en una fórmula completa debe ser 0; es decir, cuando un electrón se pierde por un átomo (+1 contribución al número de oxidación), el mismo electrón debe ser ganado por otro átomo (—1 contribución al número de oxidación).
- Si un ion poliatómico es considerado por sí mismo, la suma de los números de oxidación de sus átomos constituyentes debe ser igual a la carga sobre el ion.
Como ilustración de estas reglas, consideremos algunos ejemplos más.
Determinar el número de oxidación de cada elemento en cada una de las siguientes fórmulas: (a) NaClO; (b) ClO 4 —; y (c) MgH 2.
Solución:
a) Dado que Na es un elemento del grupo IA, su número de oxidación es +1 (regla 3 a). El número de oxidación de O suele ser —2 (regla 3 c). Por lo tanto (regla 4), +1 + número de oxidación de Cl + (—2) = 0.
\[ \text{Oxidation number of Cl} = 2 – 1 = +1 \nonumber \]
Así escribimos la fórmula
\[\overset{\text{+1}}{\mathop{\text{Na}}}\,\overset{+\text{1}}{\mathop{\text{Cl}}}\,\overset{-\text{2}}{\mathop{\text{O}}}\, \nonumber \]
si se van a incluir los números de oxidación.
b) En este caso los números de oxidación deben sumar a —1, la carga sobre el ión poliatómico. Como O suele ser —2, tenemos
\[ \text{Oxidation number of Cl} + 4(–2) = –1 \nonumber \]
\[ \text{Oxidation number of Cl} = –1 + 8 = +7 \nonumber \]
c) En MgH 2, H se combina con un elemento más electropositivo que él mismo, por lo que su número de oxidación es —1. El Mg está en el grupo IIA, por lo que su número de oxidación es +2:
\[\overset{\text{+2}}{\mathop{\text{Mg}}}\,\overset{-\text{1}}{\mathop{\text{H}}}\,_{\text{2}} \nonumber \]
Como verificación de estas asignaciones, es aconsejable asegurarse de que los números de oxidación sumen a 0:
\[ +2 + 2(–1) = 0 \qquad \text{OK} \nonumber \]
Los números de oxidación son utilizados principalmente por los químicos para identificar y manejar un tipo de reacción química llamada reacción redox, o una reacción de oxidación-reducción. Este tipo de reacción se puede reconocer porque implica un cambio en el número de oxidación de al menos un elemento. Más información sobre estas reacciones se encuentra en la sección sobre reacciones redox. Los números de oxidación también se utilizan en los nombres de los compuestos. Las reglas de nomenclatura recomendadas internacionalmente incluyen números romanos que representan números de oxidación. Por ejemplo, los dos bromuros de mercurio, Hg 2 Br 2 y HGbR 2, se denominan bromuro de mercurio (I) y bromuro de mercurio (II), respectivamente. Aquí el número I se refiere a un número de oxidación de +1 para el mercurio, y II a un número de oxidación de +2. Los números de oxidación a veces también pueden ser útiles para escribir estructuras de Lewis, particularmente para oxianiones. En el ion sulfito, SO 3 2 —por ejemplo, el número de oxidación del azufre es +4, lo que sugiere que solo cuatro electrones de azufre están involucrados en el enlace. Dado que el azufre tiene seis electrones de valencia, concluimos que dos electrones no están involucrados en el enlace, es decir, que hay un par solitario. Con esta pista, una estructura plausible de Lewis es mucho más fácil de dibujar: