7.14: Resonancia
- Page ID
- 75021
Además de las moléculas que contienen números impares de electrones, hay otra clase de moléculas que no encajan fácilmente en la teoría de pares de electrones del enlace covalente. Para estas moléculas es posible dibujar más de una estructura de Lewis que obedece a la regla del octeto pero que es insatisfactoria de otras maneras. Un ejemplo sencillo de tal molécula es el ozono, una forma inusual de oxígeno, cuya fórmula molecular es O 3. Al igual que los óxidos de nitrógeno, el ozono es importante en una discusión de problemas de contaminación atmosférica, pero por el momento nos limitaremos a su estructura.
Podemos dibujar dos diagramas de Lewis para O 3, los cuales obedecen a la regla del octeto:
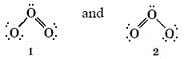
La estructura 1 sugiere que hay un enlace sencillo O-O a la izquierda y un doble enlace en el lado derecho de la molécula. La estructura 2 sugiere la colocación opuesta del doble enlace. Sin embargo, parece poco probable que los electrones sean capaces de distinguir la izquierda de la derecha de esta manera, y la evidencia experimental confirma esta sospecha. Se encuentra que ambos enlaces tienen la misma longitud, es decir, 128pm. Esto es intermedio entre la longitud de
doble enlace en el lado derecho de la molécula. La estructura 2 sugiere la colocación opuesta del doble enlace. Sin embargo, parece poco probable que los electrones sean capaces de distinguir la izquierda de la derecha de esta manera, y la evidencia experimental confirma esta sospecha. Se encuentra que ambos enlaces tienen la misma longitud, es decir, 128pm. Esto es intermedio entre la longitud de doble enlace de 121pm en O 2 y la longitud de enlace sencillo O―O de 147pm en H 2 O 2. En otras palabras, la estructura de O 2 es de alguna manera intermedia en carácter entre las dos estructuras mostradas.
doble enlace de 121pm en O 2 y la longitud de enlace sencillo O―O de 147pm en H 2 O 2. En otras palabras, la estructura de O 2 es de alguna manera intermedia en carácter entre las dos estructuras mostradas.
A nivel matemático, podemos explicar satisfactoriamente las propiedades del ozono considerando su estructura como un híbrido de las dos estructuras mostradas anteriormente, teniendo el término híbrido exactamente el mismo sentido que para los híbridos. Luego obtenemos una distribución de probabilidad electrónica en la que ambos enlaces reciben el mismo tratamiento y son de carácter intermedio entre enlaces dobles y simples. Tal estructura se llama híbrido de resonancia y se indica de una de las siguientes maneras:
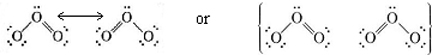
El término resonancia y el uso de una flecha de doble punta ,, son ambos lamentables ya que sugieren que la estructura oscila continuamente entre las dos alternativas, de manera que si tan solo fueras lo suficientemente rápido, podrías “atrapar” el doble enlace de un lado u otro. No se puede hacer esto más que “atrapar” instantáneamente un orbital híbrido sp en forma de orbital s o p.
,, son ambos lamentables ya que sugieren que la estructura oscila continuamente entre las dos alternativas, de manera que si tan solo fueras lo suficientemente rápido, podrías “atrapar” el doble enlace de un lado u otro. No se puede hacer esto más que “atrapar” instantáneamente un orbital híbrido sp en forma de orbital s o p.
El ejemplo más importante de resonancia es sin duda el compuesto benceno, C 6 H 6, que tiene la estructura
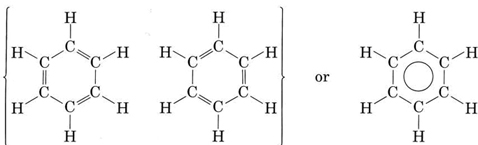
El círculo dentro de la segunda fórmula indica que todos los enlaces C—C en el hexágono son equivalentes. Este anillo hexagonal de seis átomos de carbono se llama anillo de benceno. Cada enlace carbono-carbono tiene 139pm de largo, intermedio entre la longitud de un enlace sencillo C—C (154pm) y un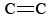 doble enlace (135pm). Mientras que un doble enlace entre dos átomos de carbono es normalmente bastante reactivo, el enlace entre los carbonos en el anillo de benceno es difícil de alterar. En prácticamente todas sus reacciones químicas, la estructura anular del benceno permanece intacta.
doble enlace (135pm). Mientras que un doble enlace entre dos átomos de carbono es normalmente bastante reactivo, el enlace entre los carbonos en el anillo de benceno es difícil de alterar. En prácticamente todas sus reacciones químicas, la estructura anular del benceno permanece intacta.
Incluso cuando una molécula exhibe resonancia, todavía es posible predecir su forma. Cualquier enlace que sea de carácter intermedio puede tratarse como si fueran enlaces simples, aunque quizás un poco más gordos. Sobre esta base se predeciría que la molécula de ozono es angular en lugar de lineal debido al par solitario en el átomo de oxígeno central, con un ángulo ligeramente inferior a 120°. Experimentalmente el ángulo es de 117°. De la misma manera se puede esperar que cada átomo de carbono en el benceno esté rodeado por tres átomos en un plano a su alrededor, separados por ángulos de aproximadamente 120°. Nuevamente esto concuerda con el experimento. Todos los átomos en C 6 H 6 se encuentran en el mismo plano, y todos los ángulos de enlace son 120°.
Escribir estructuras de resonancia para indicar la unión en el ion carbonato, CO 3 2 —. Predecir el ángulo O—C—O y la longitud del enlace carbono-oxígeno.
Solución
Primero debemos escribir una estructura de Lewis plausible para el ion. Contando electrones de valencia, tenemos un total de
4 (de C) + 3 × 6 (de O) + 2 (de carga) = 24 electrones
Hay 4 octetos a llenar, haciendo un total de 4 × 8 = 32 electrones. Debemos así contar 32 — 24 = 8 electrones dos veces, y así hay 4 pares compartidos. Dado que solo hay tres átomos de oxígeno, uno debe estar doble enlazado al átomo de carbono:
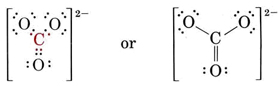
También se pueden dibujar otras dos estructuras equivalentes, y así el ion carbonato corresponde al siguiente híbrido de resonancia:
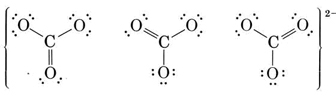
Dado que el carbono no tiene pares solitarios en su caparazón de valencia, los tres oxígenos deben estar dispuestos trigonalmente alrededor del carbono y los cuatro átomos deben estar en un plano. Como vimos en el capítulo anterior, la longitud del enlace sencillo C—O es de 143pm, mientras que la longitud del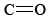 doble enlace es de 122pm. Podemos esperar que la distancia carbono-oxígeno en el ion carbonato se encuentre en algún lugar entre estos valores. Experimentalmente se encuentra que es 129pm.
doble enlace es de 122pm. Podemos esperar que la distancia carbono-oxígeno en el ion carbonato se encuentre en algún lugar entre estos valores. Experimentalmente se encuentra que es 129pm.


