8.3: Fuerzas dipolares
- Page ID
- 75715
Quizás se esté preguntando, ¿por qué las moléculas neutras deberían atraerse unas a otras? Si las moléculas son polares, la explicación es bastante obvia. Cuando dos moléculas polares se acercan entre sí, pueden organizarse de tal manera que el lado negativo de una molécula esté cerca del extremo positivo de la otra:
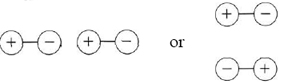
Entonces las moléculas se atraerán entre sí porque las cargas que están más cercanas entre sí son de signo opuesto. (Este comportamiento es muy similar a la atracción entre dos barras de imanes colocados extremo a extremo o lado a lado con los polos norte opuestos a los polos sur). Las fuerzas entre moléculas polares que surgen de esta manera se denominan fuerzas dipolares. La existencia de fuerzas dipolares explica por qué las moléculas polares tienen puntos de ebullición y puntos de fusión más altos que las moléculas no polares. En la siguiente tabla, comparamos los puntos de ebullición de varios pares de moléculas. En cada par, una molécula es polar y la otra no polar, pero por lo demás son lo más similares posible. La sustancia polar siempre tiene el punto de ebullición más alto, lo que indica mayores fuerzas de atracción entre moléculas separadas, es decir, mayores fuerzas intermoleculares.
| Moléculas no polares | Moléculas polares | ||||||
|---|---|---|---|---|---|---|---|
| Molécula | Masa Molar/ g mol -1 | Número Total de Electrones | Punto de ebullición (en grados C) | Molécula | Masa Molar/ g mol -1 | Número Total de Electrones | Punto de ebullición (en grados C) |
| N 2 | 28 | 14 | -196 | CO | 28 | 14 | -192 |
| SiH 4 | 32 | 18 | -112 | PH 3 | 34 | 18 | -85 |
| GeH 4 | 77 | 36 | -90 | Ash 3 | 78 | 36 | -55 |
| Br 2 | 160 | 70 | 59 | iCL | 162 | 70 | 97 |


