8.4: Fuerzas de Londres
- Page ID
- 75811
Las fuerzas dipolares explican cómo las moléculas polares pueden atraerse entre sí, pero es un poco más difícil explicar las fuerzas de atracción que existen entre moléculas completamente no polares. Incluso los gases nobles, cuyos átomos no forman enlaces químicos entre sí, pueden condensarse en líquidos a temperaturas suficientemente bajas. Esto indica que los átomos se atraen entre sí, aunque sólo débilmente. Una explicación de estas atractivas fuerzas fue dada por primera vez en 1930 por el físico austriaco Fritz London (1900 a 1954). Según su teoría, cuando dos moléculas se acercan muy de cerca, el movimiento de los electrones en una de las moléculas interfiere con el movimiento de los electrones en la otra, y el resultado neto es una fuerza atractiva. Para entender mejor las ideas de Londres, empecemos por considerar la hipotética situación que se muestra en la Figura \(\PageIndex{1}\). Cuando un dipolo se acerca a un átomo de helio, la nube de electrones del átomo de helio es atraída hacia el extremo positivo del dipolo.
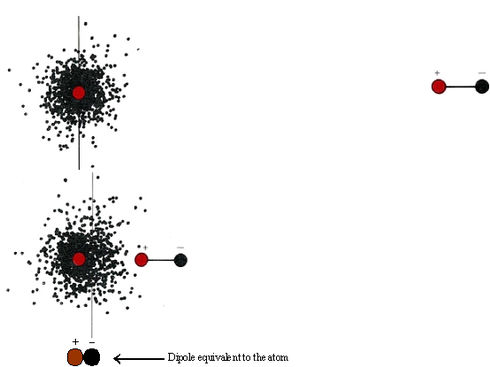
El átomo de helio se polariza y se comporta eléctricamente como si fuera un segundo dipolo, con su lado negativo apuntando hacia el lado positivo del primer dipolo. Como ya hemos visto, dos dipolos orientados de esta manera se atraen entre sí.
Si en lugar de un dipolo, ahora traemos a colación otro átomo de helio, se produce un efecto similar. Los electrones que se mueven alrededor del núcleo en este segundo átomo a menudo se encontrarán ambos momentáneamente en un lado del núcleo o ambos en el otro lado. En cualquier instante dado, por lo tanto, es probable que el átomo de helio que se aproxima sea ligeramente polar. Entonces puede comportarse como el dipolo utilizado en la figura anterior, induciendo un dipolo en el primer átomo, y resultará atracción. Así, a medida que los electrones en un átomo se mueven a su alrededor, tenderán a sincronizarse en cierta medida con el movimiento de los electrones en el otro átomo. En general habrá una fuerza de atracción entre los dos átomos de helio.
Un argumento similar al que se acaba de presentar puede aplicarse también a pares de átomos de los otros gases nobles. En efecto, explica por qué debe haber fuerzas de atracción, aunque bastante pequeñas, entre dos moléculas de cualquier tipo. Las fuerzas causadas por la polarización instantánea mutua de dos moléculas se llaman fuerzas de Londres, o a veces fuerzas de dispersión. Cuando se hace referencia a las fuerzas intermoleculares en general, ya sea a las fuerzas de Londres o dipolo o a ambas, generalmente se usa el término fuerzas de van der Waals. Johannes van der Waals (1837 a 1923) fue un científico holandés que primero se dio cuenta de que las moléculas neutras deben atraerse entre sí, a pesar de que él mismo no pudo explicar estas atracciones.
En general, cuando comparamos sustancias cuyas moléculas tienen estructuras electrónicas similares, siempre son las moléculas más grandes las que corresponden a las fuerzas más fuertes de Londres. Esta regla se ilustra por las propiedades físicas que se muestran en la siguiente tabla para los gases nobles y los halógenos. Tanto los puntos de fusión como los puntos de ebullición aumentan en el orden He < Ne < Ar < Kr < Xe y F 2 < Cl 2 < Br 2 < I 2. Esto corresponde con el orden de aumentar el radio de van der Waals, mostrando que en cada caso las moléculas más grandes son atraídas más fuertemente entre sí.
| Sustancia | van der Waals Radius*/pm | Punto de fusión (en °C) | Punto de ebullición (en °C) |
|---|---|---|---|
| Él | 93 | † | -269 |
| Ne | 112 | -248 | -246 |
| Ar | 154 | -189 | -186 |
| Kr | 169 | -157 | -153 |
| Xe | 190 | -112 | -108 |
| F 2 | 135 | -220 | -188 |
| Cl 2 | 180 | -101 | -34 |
| Br 2 | 195 | -47 | 58 |
| I 2 | 215 | 114 | 183 |
* De la figura de los radios atómicos. Tenga en cuenta que las moléculas halógenas no son esféricas. Sin embargo, el radio de van Waals de los átomos de halógeno es proporcional al tamaño molecular.
† Solo forma un sólido a presiones muy altas.
Esta dependencia del tamaño de la molécula se explica fácilmente por la teoría de Londres. En moléculas más grandes, los electrones de valencia están en general más alejados de los núcleos. La nube de electrones es más difusa, menos apretada y, por lo tanto, más fácilmente polarizable que para moléculas más pequeñas. La energía de ionización para Xe es 1170 kJ mol —1, por ejemplo, mucho menor que para Ne (2080 kJ mol —1 como se ve en la tabla de energías de ionización). Esto indica que el octeto más externo en Xe está mucho menos apretado que en Ne. Así, cuando dos átomos de Xe se acercan entre sí de cerca, el movimiento de los electrones en un átomo puede sincronizarse con el movimiento en el otro de manera más efectiva que en el caso de dos átomos de Ne.
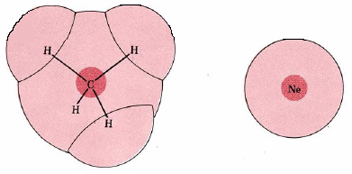
A menudo se dice que la magnitud de las fuerzas londinenses depende de la masa molar de las moléculas involucradas; si comparamos moléculas de estructura electrónica similar, las moléculas más grandes suelen ser las más pesadas. Pero esto es una coincidencia más que una relación de causa y efecto, y no siempre es cierto. Si comparamos metano, CH 4 (M = 16 g mol —1) con Ne (M = 20.2 g mol —1), por ejemplo, encontramos que la molécula más ligera tiene las fuerzas más fuertes de Londres. Ambas moléculas contienen 10 electrones, de los cuales 8 están en caparazón de valencia. En un átomo de Ne, los electrones están fuertemente retenidos por un solo núcleo de carga +10, mientras que en CH 4, esta misma carga positiva total se extiende sobre un núcleo C de carga +6 y cuatro núcleos H de carga +1. Como puede verse en la Figura 2, los electrones en CH 4 ocupan una nube de electrones mucho mayor y no están tan apretados como en Ne. Por lo tanto, son más fáciles de polarizar, y se espera que las fuerzas de Londres entre dos moléculas CH 4 sean mayores que entre dos moléculas de Ne. De acuerdo con esto encontramos un punto de ebullición mucho mayor para CH 4 (—162°C) que para Ne (—246°C).
Decidir qué sustancia en cada uno de los siguientes pares tendrá el punto de ebullición más alto:
- SiH 4 vs SnH 4 ...
- CF 4 vs CCl 4
- Kr frente a HBr
- C 2 H 6 vS.f 2
Solución
- Tanto SiH 4 como SnH 4 corresponden al mismo diagrama de Lewis. Sin embargo, en SnH 4, el octeto de valencia está en el caparazón n = 5, a diferencia del caparazón n = 3 para SiH 4. SnH 4 es la molécula más grande y debe tener el punto de ebullición más alto.
- Nuevamente las dos moléculas tienen diagramas de Lewis similares. Dado que Cl es mayor que F, concluimos que los electrones en CCl 4 se polarizan más fácilmente, y el punto de ebullición será mayor para este compuesto.
- Tanto Kr como HBr tienen el mismo número de electrones. HBr, sin embargo, es polar y por lo tanto tiene el punto de ebullición más alto.
- Ambas moléculas tienen el mismo número total de electrones, es decir, 18, pero en C 2 H 6 la nube de electrones se distribuye alrededor de ocho núcleos en lugar de dos. Esta nube más grande se polariza más fácilmente para que podamos esperar fuerzas londinenses más fuertes. C 2 H 6, F 2 tendrá así el punto de ebullición más alto.
Tenga en cuenta que no siempre es posible decidir cuál de las dos sustancias tiene el punto de ebullición más alto a pesar de que sus estructuras electrónicas son muy similares. Un caso en el punto es el par de sustancias HCl e HI. Podemos esperar que el HCl sea más polar que el HI para que las fuerzas dipolares entre las moléculas de HCl sean mayores que para las moléculas de HI. Las fuerzas londinenses, sin embargo, estarán al revés ya que el HI es mucho más grande en tamaño que el HCl. Sucede que el efecto de las fuerzas londinenses es mayor; se encuentra que el Hi tiene un punto de ebullición más alto (—38°C) que el HCl (—88°C).


