8.6: Alcanos
- Page ID
- 75665
La mayoría de los hidrocarburos en el petróleo pertenecen a una familia de compuestos llamados los alcanos, en los que todos los átomos de carbono están unidos por enlaces simples.
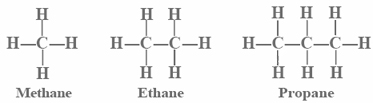
Los modelos de bolas y barras de moléculas de alcano que contienen hasta tres átomos de carbono se muestran en la Figura\(\PageIndex{1}\). El metano (a) tiene cuatro enlaces C—H dispuestos tetraédricamente alrededor de un solo átomo de carbono. El etano (b) tiene una estructura ligeramente más complicada: cada carbono todavía está rodeado tetraédricamente por cuatro enlaces, pero solo tres son enlaces C―H, mientras que el cuarto es un enlace C—C. El etano puede considerarse como dos grupos metilo conectados por un solo enlace C-C. (El grupo metilo, CH 3 —, tiene la misma estructura que el metano excepto que se ha eliminado un hidrógeno). Así, la fórmula para etano es CH 3 CH 3 o C 2 H 6.
El tercer miembro de la familia de alcanos es el propano. Como puede verse en la parte c, los tres átomos de carbono están en una cadena. Los dos grupos metilo en los extremos de la cadena están unidos entre sí por un grupo metileno, —CH 2 —. La fórmula es CH 3 CH 2 CH 3 o C 3 H 8. Nuevamente se mantiene la disposición tetraédrica de los enlaces C—H o C-C alrededor de cada átomo de carbono.
La mayoría de nosotros carecemos de la habilidad artística para hacer buenos bocetos tridimensionales de las estructuras moleculares de alcanos u otros compuestos orgánicos. En consecuencia, se utilizan comúnmente fórmulas de proyección, que indican cómo están conectados los átomos pero no muestran ángulos tetraédricos de 109.5°. Las fórmulas de proyección para los tres miembros de la familia de alcanos son
Claramente podríamos pasar a cadenas de cuatro, cinco, seis o más átomos de carbono agregando más grupos metileno a la molécula de propano. Los primeros 10 compuestos cuyas estructuras pueden derivarse de esta manera se enumeran en la siguiente tabla. Se denominan alcanos normales o alcanos de cadena lineal, indicando que todos contienen una sola cadena continua de átomos de carbono y pueden ser representados por una fórmula de proyección cuyos átomos de carbono están en línea recta.
| Nombre | Fórmula molecular | Modelo 3D | Fórmula estructural condensada | Punto de ebullición (°C) |
|---|---|---|---|---|
| Metano | CH 4 |  |
CH 4 | -162 |
| Etano | C 2 H 6 |  |
CH 3 CH 3 | -89 |
| Propano | C 3 H 8 |  |
CH 3 CH 2 CH 3 | -42 |
| n -Butano | C 4 H 10 | 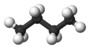 |
CH 3 (CH 2) CH 3 | -0.5 |
| n-Pentano | C 5 H 12 | 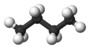 |
CH 3 (CH 2) 3 CH 3 | 36 |
| n -Hexano | C 6 H 14 | 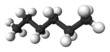 |
CH 3 (CH 2) 4 CH 3 | 69 |
| n -heptano | C 7 H 16 | 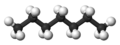 |
CH 3 (CH 2) 5 CH 3 | 98 |
| n -Octano | C 8 H 18 |  |
CH 3 (CH 2) 6 CH 3 | 126 |
| n -Nonano | C 9 H 20 |  |
CH 3 (CH 2) 7 CH 3 | 151 |
| n -Decano | C 10 H 22 |  |
CH 3 (CH 2) 8 CH 3 | 174 |
* La n antes del nombre indica que este es el isómero normal de cadena lineal.
Obsérvese que todas las fórmulas de proyección de la tabla tienen un átomo de hidrógeno inicial seguido de varios grupos CH 2. La cadena termina con un segundo solo átomo de hidrógeno. Se puede escribir la fórmula general H (CH 2) n H, o C n H 2 n +2, donde n es el número de grupos CH 2, o el número de átomos de C. El propano, por ejemplo, tiene n = 3. Su fórmula es C 3 H 8 y se le conoce como un hidrocarburo C 3.
Cadenas ramificadas e isómeros
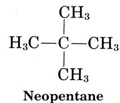
Otra característica importante de la estructura molecular es ilustrada por los hidrocarburos C 4. Además de la cadena lineal que se muestra para el butano normal, es posible una cadena ramificada, en la que algunos átomos de carbono están unidos a más de otros dos carbonos. La fórmula de proyección para el compuesto de cadena ramificada 2-metilpropano (también llamado isobutano porque es un isómero del butano) es
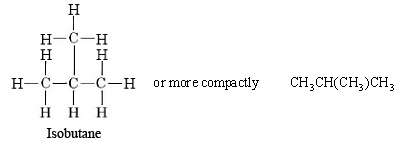
A diferencia del butano normal, que tiene una cadena recta de cuatro átomos de carbono, la cadena más larga en isobutano tiene solo tres átomos de carbono de largo. El centro de estos tres átomos está unido al cuarto carbono. Sin embargo, se puede verificar a partir de las fórmulas de proyección o de los dibujos de bola y barra que tanto el butano normal como el isobutano tienen la misma fórmula molecular, C 4 H 10. Los dos compuestos son isómeros, al igual que el alcohol etílico y el éter dimetílico, de ahí el prefijo iso en el nombre de uno de ellos. Así como se mencionó con el alcohol etílico y el éter dimetílico, el n-butano y el isobutano difieren en sus propiedades físicas. El isobutano, al ser más compacto, tiene interacciones London Force más pequeñas que el n-butano. Así tiene un punto de ebullición más bajo. Los puntos de ebullición se pueden comparar en la tabla de puntos de ebullición de compuestos orgánicos. Cabe señalar de esta tabla que de todos los compuestos orgánicos a considerar, los alcanos, tanto de cadena lineal como ramificada, tienen los puntos de ebullición más bajos comparativamente.
A medida que aumenta el número de átomos de carbono en una molécula de alcano, también lo hacen las posibilidades de isomería de este tipo. Hay tres pentanos isoméricos, todos con la fórmula C 5 H 12, cinco hexanos isoméricos, C 6 H 14, y nueve heptanos isoméricos, C 7 H 16. El número de posibles isómeros del tetracontano, C 40 H 82 es mayor a 62 millones. Por lo tanto, es posible una variedad inconcebible de diferentes estructuras moleculares para compuestos que contienen solo átomos de carbono e hidrógeno conectados por enlaces simples. En el petróleo crudo, la fuente más importante de hidrocarburos en Estados Unidos, los alcanos de cadena ramificada y lineal son casi igualmente comunes.
Otro aspecto del comportamiento de las moléculas de alcano (y otras moléculas que contienen enlaces simples) no es evidente a partir de las ilustraciones de bolas y palos o de las fórmulas de proyección. Al igual que los niños pequeños, las moléculas no pueden dejar de retorcerse y la mayoría de las estructuras de alcanos no son Los grupos a cada lado de un enlace sencillo carbono-carbono pueden rotar libremente entre sí. La rotación de un grupo metilo con respecto al otro en etano, CH 3 CH 3, se muestra en la Figura\(\PageIndex{3}\). Si bien hay rotación libre alrededor del enlace de carbono, ciertas posiciones son más estables que otras. Para la molécula de etano es más estable cuando los átomos de hidrógeno en un grupo metilo se compensan de los del otro grupo metilo (denominados escalonados) y se necesita más energía para pasar a través de la formación eclipsada, donde los átomos de hidrógeno de ambos grupos metilo se alinean. Debido a esta rotación libre, y debido a que chocan con otras moléculas, las moléculas de alcano se flexionan constantemente y retorciéndose alrededor de sus enlaces C―C, asumiendo diferentes formas (diferentes conformaciones) todo el tiempo. A partir del siguiente ejemplo se obtiene cierta sensación de la forma en que las moléculas de alcano pueden adoptar una variedad de conformaciones.

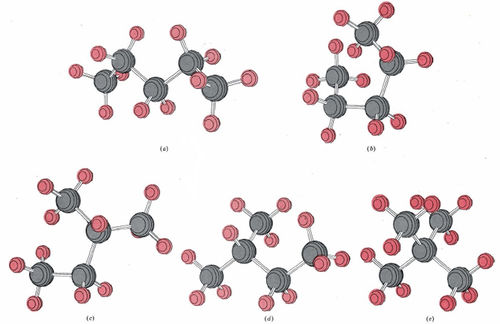
En la Figura\(\PageIndex{4}\), se muestran cinco diagramas de bola y varilla etiquetados (a) a (e). Los cinco corresponden a la fórmula C 5 H 12 (pentano). Dado que solo hay tres isómeros del pentano, algunas de estas moléculas deben corresponder a diferentes puntos de vista o diferentes conformaciones de una misma molécula. Decidir cuál de estos diagramas corresponde al mismo isómero, y qué isómero representa cada uno. Dibuja una fórmula de proyección para cada isómero.
Solución
La molécula (a) tiene cinco átomos de carbono en una sola secuencia continua. Corresponde a
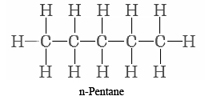
Una cuidadosa inspección de (b) revela que nuevamente los cinco átomos de carbono forman una sola cadena. Ningún átomo de carbono se une a más de otros dos. La molécula (b) es así también n-pentano, pero en una conformación diferente. La molécula (c) tiene un átomo de carbono unido a otros tres. La cadena más larga tiene cuatro átomos de carbono de largo, y un átomo de carbono adicional está unido al segundo átomo de carbono. La fórmula de proyección es en consecuencia
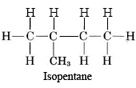
La molécula (d) también es isopentano, mientras que la molécula (e) corresponde al tercer isómero, llamado neopentano: