8.6.1: Astronomía- Titán
- Page ID
- 75676
Los hidrocarburos más simples son los alcanos, compuestos compuestos de solo carbono e hidrógeno unidos entre sí por enlaces simples. Cada átomo de carbono tiene geometría tetraédrica a su alrededor, con ángulos de 109.5°. A continuación se muestran diagramas simples y estructuras tridimensionales de jmol de tres alcanos.
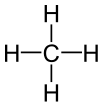 Metano |
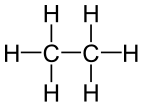 Etano Etano |
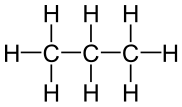 Propano |
|
Figura Modelo de\(\PageIndex{1}\) bola y barra para los tres primeros miembros de la familia de alcanos: (a) metano, CH 4; (b) etano, C 2 H 6; (c) propano, C 3 H 8. |
Los alcanos son muy no polares debido a su simetría y falta general de dipolos entre los átomos de carbono e hidrógeno.
Al observar el tamaño general y la no polaridad de las moléculas mostradas anteriormente, ¿qué se puede inferir sobre las fuerzas intermoleculares entre ellas? Relacionar la presencia de estas fuerzas con los puntos de fusión y ebullición esperados de estos alcanos comparados entre sí y con una molécula más polar, como el agua.
Responder
Los alcanos mostrados casi no tienen dipolo neto y son moléculas relativamente pequeñas. Por lo tanto, las únicas fuerzas intermoleculares involucradas son las fuerzas londinenses. Debido a que el propano es más grande, habrá más fuerzas de atracción en Londres que mantienen unidas las moléculas de propano en comparación con el etano y el metano, por lo que el propano tendrá puntos de fusión y ebullición Sin embargo, las fuerzas siguen siendo bastante débiles, y esperaríamos que estos alcanos tuvieran puntos de fusión y ebullición más bajos que una molécula polar como el agua.
Las fuerzas intermoleculares en cada molécula son lo suficientemente débiles hasta el punto en que el metano, el etano y el propano se encuentran normalmente como gases a temperatura ambiente. Estos hidrocarburos existen en áreas concentradas del espacio, sobre todo en la luna saturniana Titán. Titán es único en que en tiene una atmósfera muy densa rica en hidrocarburos y lagos de alcanos simples [1]. Los cuerpos de metano y etano juegan casi el mismo papel en Titán que el líquido en la Tierra. El propano más pesado, utilizado por los humanos como combustible fósil, está presente en más de 700 millones de barriles terrestres [2]. Actualmente los científicos intentan averiguar qué produce estos hidrocarburos en Titán, pero por ahora, exploremos más la geometría y nomenclatura de estas tres moléculas.

Metano, Etano y Propano
Los modelos de bolas y palos de moléculas de alcano que contienen hasta tres átomos de carbono se muestran en la Figura 1. El metano (a) tiene cuatro enlaces C—H dispuestos tetraédricamente alrededor de un solo átomo de carbono. El etano (b) tiene una estructura ligeramente más complicada: cada carbono todavía está rodeado tetraédricamente por cuatro enlaces, pero solo tres son enlaces C―H, mientras que el cuarto es un enlace C—C. El etano puede considerarse como dos grupos metilo conectados por un solo enlace C-C. (El grupo metilo, CH 3 —, tiene la misma estructura que el metano excepto que se ha eliminado un hidrógeno). Así, la fórmula para etano es CH 3 CH 3 o C 2 H 6.
El tercer miembro de la familia de alcanos es el propano. Como puede verse en la parte c, los tres átomos de carbono están en una cadena. Los dos grupos metilo en los extremos de la cadena están unidos entre sí por un grupo metileno, —CH 2 —. La fórmula es CH 3 CH 2 CH 3 o C 3 H 8. Nuevamente se mantiene la disposición tetraédrica de los enlaces C—H o C-C alrededor de cada átomo de carbono.
Cada una de ellas representa una de las estructuras moleculares 3-D mostradas en los Jmoles en la Figura 1. Debe comparar las fórmulas de proyección con los Jmols de bola y palo, tratando de visualizar las proyecciones planas en tres dimensiones.
Claramente podríamos pasar a cadenas de cuatro, cinco, seis o más átomos de carbono agregando más grupos metileno a la molécula de propano. Los primeros 10 compuestos cuyas estructuras pueden derivarse de esta manera se listan en la siguiente tabla. Se denominan alcanos normales o alcanos de cadena lineal, indicando que todos contienen una sola cadena continua de átomos de carbono y pueden ser representados por una fórmula de proyección cuyos átomos de carbono están en línea recta.
Tabla\(\PageIndex{1}\) Primero 10 alcanos
| Nombre | Fórmula molecular | Modelo 3D | Fórmula estructural condensada | Punto de ebullición (o C) |
|---|---|---|---|---|
| Metano | CH 4 |  |
CH 4 | -162 |
| Etano | C 2 H 6 |  |
CH 3 CH 3 | -89 |
| Propano | C 3 H 8 | 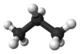 |
CH 3 CH 2 CH 3 | -42 |
| n -Butane* | C 4 H 10 | 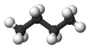 |
CH 3 (CH 2) CH 3 | -0.5 |
| n -Pentano* | C 5 H 12 | 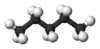 |
CH 3 (CH 2) 3 CH 3 | 36 |
| n -Hexano* | C 6 H 14 | 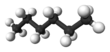 |
CH 3 (CH 2) 4 CH 3 | 69 |
| n -Heptano* | C 7 H 16 | 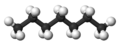 |
CH 3 (CH 2) 5 CH 3 | 98 |
| n -Octano* | C 8 H 18 | 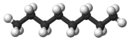 |
CH 3 (CH 2) 6 CH 3 | 126 |
| n -Nonano* | C 9 H 20 | 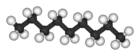 |
CH 3 (CH 2) 7 CH 3 | 151 |
| n -Decán* | C 10 H 22 | 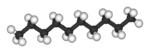 |
CH 3 (CH 2) 8 CH 3 | 174 |
* Por favor vea la siguiente sección.
Obsérvese que todas las fórmulas de proyección de la tabla tienen un átomo de hidrógeno inicial seguido de varios grupos CH 2. La cadena termina con un segundo solo átomo de hidrógeno. Se puede escribir la fórmula general H (CH 2) n H, o C n H 2 n +2, donde n es el número de grupos CH 2, o el número de átomos de C. El propano, por ejemplo, tiene n = 3. Su fórmula es C 3 H 8 y se le conoce como un hidrocarburo C 3.
Isómeros de alcano
La designación n frente a hidrocarburos butano y superiores designan un isómero normal de cadena lineal, sin ramificaciones de carbono. Además de la cadena lineal que se muestra para el butano normal, es posible una cadena ramificada, en la que algunos átomos de carbono están unidos a más de otros dos carbonos. La fórmula de proyección para el compuesto de cadena ramificada 2-metilpropano (también llamado isobutano porque es un isómero del butano) es
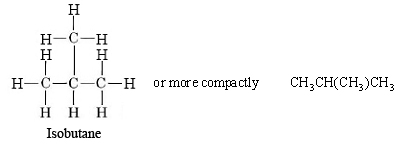
|
Figura\(\PageIndex{4}\) Los dos isómeros de butano, C 4H 10, n-butano e isobutano, también llamados 2-metil-propano. |
A diferencia del butano normal, que tiene una cadena recta de cuatro átomos de carbono, la cadena más larga en isobutano tiene solo tres átomos de carbono de largo. El centro de estos tres átomos está unido al cuarto carbono. Sin embargo, se puede verificar a partir de las fórmulas de proyección o de los dibujos de bola y barra que tanto el butano normal como el isobutano tienen la misma fórmula molecular, C 4 H 10. Los dos compuestos son isómeros, al igual que el alcohol etílico y el éter dimetílico, de ahí el prefijo iso en el nombre de uno de ellos. Los isómeros tienen la misma fórmula estructural, pero a menudo tienen propiedades diferentes. El isobutano, al ser más compacto, tiene interacciones London Force más pequeñas que el n-butano, y por lo tanto un punto de ebullición más bajo. Los puntos de ebullición se pueden comparar en la tabla de puntos de ebullición de compuestos orgánicos. Cabe señalar de esta tabla que de todos los compuestos orgánicos a considerar, los alcanos, tanto de cadena lineal como ramificada, tienen los puntos de ebullición más bajos comparativamente.
A medida que aumenta el número de átomos de carbono en una molécula de alcano, también lo hacen las posibilidades de isomería de este tipo. Hay tres pentanos isoméricos, todos con la fórmula C 5 H 12, cinco hexanos isoméricos, C 6 H 14, y nueve heptanos isoméricos, C 7 H 16. El número de posibles isómeros del tetracontano, C 40 H 82 es mayor a 62 millones. Por lo tanto, es posible una variedad inconcebible de diferentes estructuras moleculares para compuestos que contienen solo átomos de carbono e hidrógeno conectados por enlaces simples. En el petróleo crudo, la fuente más importante de hidrocarburos en Estados Unidos, los alcanos de cadena ramificada y lineal son casi igualmente comunes.
Otro aspecto del comportamiento de las moléculas de alcano (y otras moléculas que contienen enlaces simples) no es evidente a partir de las ilustraciones de bolas y palos o de las fórmulas de proyección. Al igual que los niños pequeños, las moléculas no pueden dejar de retorcerse y la mayoría de las estructuras de alcanos no son Los grupos a cada lado de un enlace sencillo carbono-carbono pueden rotar libremente entre sí. La rotación de un grupo metilo con respecto al otro en etano, CH 3 CH 3, se muestra en la Figura 5. Si bien hay rotación libre alrededor del enlace de carbono, ciertas posiciones son más estables que otras. Para la molécula de etano es más estable cuando los átomos de hidrógeno en un grupo metilo se compensan de los del otro grupo metilo (denominados escalonados) y se necesita más energía para pasar a través de la formación eclipsada, donde los átomos de hidrógeno de ambos grupos metilo se alinean. Debido a esta rotación libre, y debido a que chocan con otras moléculas, las moléculas de alcano se flexionan constantemente y retorciéndose alrededor de sus enlaces C―C, asumiendo diferentes formas (diferentes conformaciones) todo el tiempo. A partir del siguiente ejemplo se obtiene cierta sensación de la forma en que las moléculas de alcano pueden adoptar una variedad de conformaciones.
 Figura\(\PageIndex{5}\) In all alkanes, portions of the molecule can flex or rotate about all the single carbon-carbon bonds. (a) Shown in the animated figure is the rotation of one methyl group, CH3, with respect to the other in a molecule of ethane, CH3CH3. It takes more energy to go through the eclipsed formation, where hydrogen atoms on both methyl groups line up. (b) A movie showing the rotation, vibration and translation of hexane (C6H14). See if you can find where the tail-end CH3 group rotates like the image in part (a). |
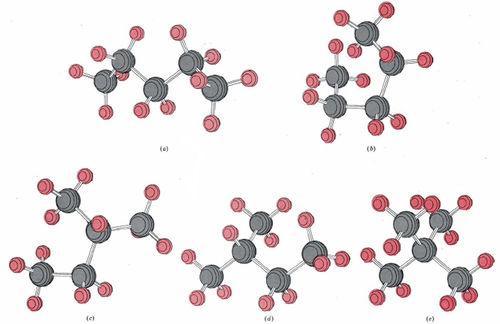
In Figure \(\PageIndex{6}\), five ball-and-stick diagrams labeled (a) through (e) are shown. All five correspond to the formula C5H12 (pentane). Since there are only three isomers of pentane, some of these molecules must correspond to different views or different conformations of the same molecule. Decide which of these diagrams correspond to the same isomer, and which isomer each represents. Draw a projection formula for each isomer.
Solution When given illustrations of molecules in 3D form, it is often helpful to draw them simply in 2D and compare how different atoms bonds to each other. Molecule (a) has five carbon atoms in a single continuous sequence. It corresponds to
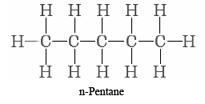
Careful inspection of (b) reveals that again the five carbon atoms form a single chain. No carbon atom is joined to more than two others. Molecule (b) is thus also n-pentane, but in a different conformation. Molecule (c) does have a carbon atom joined to three others. The longest chain is four carbon atoms long, and an additional carbon atom is attached to the second carbon atom. The projection formula is accordingly
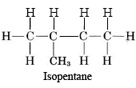
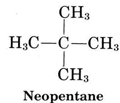
Molecule (d) is also isopentane, while molecule (e) corresponds to the third isomer, called neopentane:
From ChemPRIME: 8.5: Alkanes


