8.8: Propiedades de los alcanos
- Page ID
- 75637
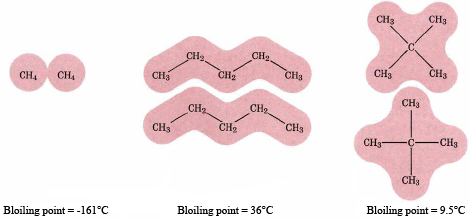
Al igual que otras cosas, cuantos más átomos de carbono, mayor sea el punto de ebullición de un alcano. Como se puede ver en la tabla de alcanos de cadena lineal, los puntos de ebullición se elevan constantemente desde CH 4 que tiene un punto de ebullición de -162 o C a C 10 H 22 que tiene un punto de ebullición de 174 o C ya que cada grupo CH 2 adicional se agrega a la cadena.
La razón de este aumento es un incremento en las fuerzas intermoleculares. Como se muestra en la siguiente figura, las moléculas más grandes pueden hacer contacto cercano entre sí sobre una superficie mucho mayor que las moléculas más pequeñas. La fuerza total ejercida entre los dos es así mayor. De la misma manera también podemos explicar por qué los hidrocarburos de cadena ramificada hierven a temperaturas más bajas que los compuestos de cadena lineal. Las moléculas ramificadas son más compactas y proporcionan menos área sobre la cual pueden actuar las fuerzas intermoleculares.
Los alcanos son bastante poco reactivos y no se combinan fácilmente con otras sustancias. Sin embargo, cuando se calientan suficientemente, se queman en el aire, proceso conocido como combustión:
\[\text{CH}_{\text{4}}(g) + \text{ 2O}_{\text{2}}(g)\rightarrow \text{ CO}_{\text{2}}(g) + \text{ 2H}_{\text{2}}\text{O}(g) \nonumber \]Δ H m = —890.4 kJ mol —1
El siguiente video muestra esta reacción de combustión del metano con oxígeno:
Se encienden dos globos, uno lleno de metano y otro lleno con una mezcla 1:1 en volumen de metano y oxígeno. El video también muestra estas reacciones en la oscuridad, donde es más fácil ver la diferencia. El globo de mezcla de oxígeno/metano explota mucho más violentamente. Al observar la ecuación anterior, es fácil entender por qué. La mezcla en ese globo está mucho más cerca de la estequiometría de la reacción que el globo de metano puro, que debe reaccionar con el oxígeno en la atmósfera con la que no se mezcla. Tenga en cuenta que los principales productos de esta reacción son el agua, el CO 2 y el calor. La combustión libera grandes cantidades de calor; no es sorprendente que el uso más importante de los alcanos sea como combustibles. El gas natural es principalmente (aproximadamente 85 por ciento) metano.
El propano o gas licuado de petróleo que se vende en tanques para uso portátil suele ser una mezcla de propano y butano. Aunque ambos son gases a temperatura y presión ordinarias, se licuan bajo presión en el tanque. La gasolina es una mezcla más compleja de alcanos que tienen de 5 a 12 átomos de carbono. La gasolina de mejor calidad generalmente contiene un mayor porcentaje de alcanos de cadena ramificada que la de grado regular. El queroseno contiene alcanos C 10 a C 16, mientras que el aceite de calentamiento generalmente involucra el rango de C 12 a C 18. Incluso los alcanos de cadena más larga se encuentran en el aceite lubricante, C 15 a C 25 y cera de parafina (utilizada para velas y papel encerado), C 23 a C 29.
La variación del punto de ebullición con la longitud de la cadena en los alcanos proporciona un método sencillo para separarlos parcialmente entre sí en el petróleo. Cuando se calienta el petróleo, los compuestos de cadena más corta comienzan a hervir inicialmente. Estos se pueden recoger enfriando el vapor hasta que se vuelva a condensar a un líquido. A medida que avanza la ebullición, la temperatura aumenta y los compuestos de cadena más larga y más larga hierven. Finalmente solo quedan los compuestos de cadena muy larga. Tal proceso se llama destilación fraccionada y se discute más a fondo en la sección sobre destilación. La destilación fraccionada juega un papel importante en la refinación del petróleo, que es una serie de procesos físicos y químicos mediante los cuales se obtienen los componentes más valiosos y útiles del petróleo crudo natural.
Los alcanos son ejemplos típicos de compuestos no polares. Las electronegatividades del carbono y el hidrógeno son 2.5 y 2.1, respectivamente, por lo que el enlace C—H casi no tiene polaridad. En consecuencia, incluso las moléculas de hidrocarburos más asimétricas tienen momentos dipolares muy pequeños. Por lo tanto, podemos tomar el comportamiento del punto de ebullición de los alcanos como representativo de otras sustancias no polares. Las moléculas simples son gases, mientras que las moléculas de tamaño mediano son líquidos, y solo las moléculas bastante grandes son sólidos.
Chiralidad
Los alcanos tienen carbonos con cuatro enlaces sencillos. En la mayoría de los ejemplos que has visto, estos son todos a hidrógeno o a otros átomos de carbono. Posteriormente, veremos moléculas donde el carbono está unido a otros elementos como el oxígeno o el nitrógeno. Sin embargo, incluso cuando el carbono solo se une al hidrógeno y al carbono, todavía vemos un tipo de estereoisomería que es diferente al isomerismo cis/trans. Echa un vistazo a
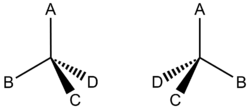
Un ejemplo sencillo de dos cosas que son estereoisómeros son nuestras manos. No importa lo que hagas, no puedes poner una mano encima de la otra y tener ambas palmas hacia abajo y los pulgares apuntando en la misma dirección. Lo mismo es cierto para las moléculas de la Figura 1. No hay forma de rotar una molécula para que A apunte hacia arriba, y todas las demás especies apunten en direcciones similares a la otra molécula. Para obtener un isómero óptico de un carbono quiral, el estereocentro debe invertirse. Esto es muy parecido al reflejo a través de un espejo. Si sostienes una mano derecha hacia un espejo y la comparas con tu mano izquierda (no reflejada a través de un espejo), ¡encontrarás que la imagen especular de tu mano derecha coincide con tu mano izquierda!
Para encontrar carbonos quirales en un alcano simple, encuentra cualquier carbono que tenga cuatro cosas diferentes unidas a él. Por ejemplo, en la siguiente molécula, vea cómo hay un hidrógeno, una cadena de tres carbonos (grupo propilo), una cadena de dos carbonos (grupo etilo) y una cadena de un carbono (grupo metilo) unida al carbono central.
| Gire esta molécula (3-metilhexano) para ver cómo el 3er carbono a lo largo de la cadena más larga es quiral. |
Encuentra todos los carbonos quirales en las siguientes moléculas.

Solución. Primero, nombraremos la molécula de acuerdo con los lineamientos de la IUPAC. La molécula de la izquierda se llama 2,5-dimetilheptano, la numeración comienza para obtener los números globales más bajos y por lo tanto comienza con el carbono 1 en el extremo derecho. Esta molécula tiene dos posibilidades. Los carbonos 2 y 5, ya que todos los demás carbonos tienen al menos dos hidrógenos y por lo tanto no pueden ser quirales. El Carbono 2 tiene un hidrógeno, la cadena larga, y luego dos grupos metilo y por lo tanto no es quiral. El carbono 5 tiene un hidrógeno, un metilo, un etilo y luego una larga cadena carbonada y por lo tanto es de hecho quiral.
La segunda molécula se denomina 3,4,5-trimetilheptano y es simétrica, por lo que la numeración es la misma desde cualquier lado. Debido a esta simetría, el carbono central (carbono 4) no puede ser quiral (las dos cadenas largas son idénticas). Así, solo los carbonos 3 y 5 son quirales. Ambas moléculas se muestran nuevamente a continuación con sus carbonos quirales -o estereocentros- indicados por un punto negro.