8.10: Hidrocarburos no saturados
- Page ID
- 75588
Dos familias importantes de hidrocarburos que no se encuentran en el petróleo son los alquenos (también llamados olefinas) y los alquinos (también llamados acetileno). Como ya se puede ver, a menudo hay dos nombres para compuestos orgánicos simples. Desde 1930 la Unión Internacional de Química Pura y Aplicada (IUPAC) ha desarrollado un método sistemático para nombrar a todos los compuestos orgánicos, pero muchos de los nombres anteriores aún sobreviven, particularmente entre los químicos industriales. En su caso, se darán ambos nombres, el nombre más antiguo entre paréntesis. Las moléculas de alqueno son similares a las moléculas de alcano, excepto que contienen un doble enlace carbono-carbono (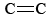 ) y dos átomos de H menos. Tienen así la fórmula general C n H 2 n. Las moléculas de alquino contienen enlaces triples (
) y dos átomos de H menos. Tienen así la fórmula general C n H 2 n. Las moléculas de alquino contienen enlaces triples ( ) y tienen cuatro átomos de H menores que el alcano correspondiente. Su fórmula general es así C n H 2 n —2. Los compuestos que contienen enlaces dobles o triples a menudo se denominan colectivamente compuestos insaturados. Debido a sus múltiples enlaces, los alquenos y alquinos suelen ser más reactivos químicamente que los alcanos y los hidrocarburos aromáticos.
) y tienen cuatro átomos de H menores que el alcano correspondiente. Su fórmula general es así C n H 2 n —2. Los compuestos que contienen enlaces dobles o triples a menudo se denominan colectivamente compuestos insaturados. Debido a sus múltiples enlaces, los alquenos y alquinos suelen ser más reactivos químicamente que los alcanos y los hidrocarburos aromáticos.
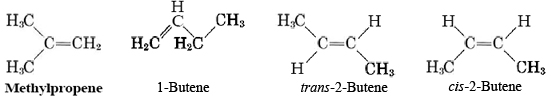
La presencia de un doble o triple enlace en la molécula abre muchas más posibilidades de isomería que en el caso de los alcanos. Por lo general, existen varias ubicaciones alternativas para el enlace múltiple, y en el caso de un doble enlace existe la posibilidad de isomería cis-trans. Así, si bien solo hay dos moléculas de alcano posibles con cuatro átomos de carbono, son posibles cuatro moléculas de alqueno:
La imagen de enlaces doblados facilita la explicación de varias características de los dobles enlaces. Como se señala en Enlace Químico - Pares de Electrones y Octetos, la distancia entre dos núcleos atómicos conectados por un doble enlace es más corta que si estuvieran conectados por un enlace sencillo. En el caso de los enlaces carbono-carbono, por ejemplo, la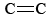 distancia es de 133pm, mientras que la distancia C—C es de 156pm. Esto tiene sentido cuando nos damos cuenta de que cada enlace doblado se extiende a lo largo de un camino curvo. La distancia entre los extremos de tal camino (los núcleos C) es necesariamente más corta que el camino mismo.
distancia es de 133pm, mientras que la distancia C—C es de 156pm. Esto tiene sentido cuando nos damos cuenta de que cada enlace doblado se extiende a lo largo de un camino curvo. La distancia entre los extremos de tal camino (los núcleos C) es necesariamente más corta que el camino mismo.
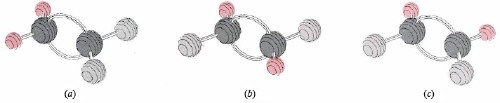
Otra característica de los dobles enlaces es que dificultan torcer un extremo de una molécula con relación al otro. Este fenómeno suele llamarse barrera a la rotación. Tal barrera explica el hecho de que es posible preparar tres compuestos diferentes con la fórmula C 2 H 2 F 2. Sus estructuras se muestran en la Figura 2. La estructura (a) es única porque ambos átomos F están unidos al mismo átomo de C, pero (b) y (c) difieren solo por un giro de 180° del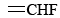 grupo de la derecha. Si no hubiera barrera para la rotación alrededor del doble enlace, las estructuras (b) y (c) podrían interconvertirse muy rápidamente cada vez que chocan con otras moléculas. Entonces sería imposible preparar una muestra que contenga solo moléculas tipo (b) o solo moléculas de tipo (c).
grupo de la derecha. Si no hubiera barrera para la rotación alrededor del doble enlace, las estructuras (b) y (c) podrían interconvertirse muy rápidamente cada vez que chocan con otras moléculas. Entonces sería imposible preparar una muestra que contenga solo moléculas tipo (b) o solo moléculas de tipo (c).
Dado que tienen la misma fórmula molecular, (a), (b) y (c) son isómeros. La estructura (b) en la que los dos átomos F están en lados opuestos del doble enlace se denomina isómero trans, mientras que la estructura (c) en la que dos átomos similares están en el mismo lado se denomina isómero cis. Es fácil explicar por qué existe una barrera a la rotación que impide la interconversión de estos isómeros cis y trans en términos de nuestro modelo de enlaces doblados. La rotación de una parte de la molécula alrededor de la línea a través de los átomos de C hará que una de las nubes de electrones de enlace doblado se tuerza alrededor de la otra. A menos que la mitad del doble enlace se rompa, es imposible torcer la molécula a través de un ángulo muy grande.
Aunque los alquenos no están presentes en el petróleo crudo, se producen en grandes cantidades en la refinación de petróleo. Muchos de los hidrocarburos del petróleo crudo tienen cadenas muy largas y son sólidos o líquidos almibarados espesos a temperaturas ordinarias debido a sus fuerzas intermoleculares relativamente grandes. El producto petrolero más importante, la gasolina, requiere moléculas que contengan de 6 a 12 átomos de carbono. Estos se pueden obtener calentando los compuestos de cadena más larga. Estas grandes moléculas se retuercen tan rápido a temperaturas más altas que se “agrietan” o se rompen en fragmentos más pequeños. Por lo general, se agrega un catalizador para acelerar la reacción, lo que se denomina craqueo catalítico. Cuando se produce el agrietamiento, se producen una molécula de alqueno y una alcano:
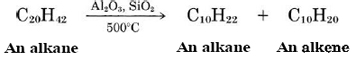 Los alquenos más importantes desde el punto de vista industrial son los dos más simples: el eteno (etileno)
Los alquenos más importantes desde el punto de vista industrial son los dos más simples: el eteno (etileno)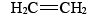 y el propeno (propileno),
y el propeno (propileno),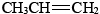 . Casi 1.11 × 10 11 kg de eteno y 6.9 × 10 10 kg de propeno se consumieron a nivel mundial en 2006 [1]. Ambos se utilizan en la fabricación de plásticos. También son materias primas para la producción de detergentes, anticongelantes, elásticos y aceites lubricantes.
. Casi 1.11 × 10 11 kg de eteno y 6.9 × 10 10 kg de propeno se consumieron a nivel mundial en 2006 [1]. Ambos se utilizan en la fabricación de plásticos. También son materias primas para la producción de detergentes, anticongelantes, elásticos y aceites lubricantes.
Entre los alquinos sólo los dos más simples son de alguna importancia industrial. Tanto el etino (acetileno) como el propiino (metil acetileno)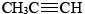 , se utilizan en soldadura y corte de acero donde se queman junto con gas oxígeno puro en una antorcha de oxiacetileno.
, se utilizan en soldadura y corte de acero donde se queman junto con gas oxígeno puro en una antorcha de oxiacetileno. Sin embargo, a medida que disminuyen los suministros de petróleo, el acetileno puede volverse más importante como material de partida para la fabricación de otros productos químicos, ya que puede estar hecho de carbón.
Sin embargo, a medida que disminuyen los suministros de petróleo, el acetileno puede volverse más importante como material de partida para la fabricación de otros productos químicos, ya que puede estar hecho de carbón.
- Thomasson, A. “El CMAI anuncia la finalización de los análisis mundiales de olefinas; el análisis mundial de olefinas ligeras y el análisis mundial de butadieno”. Chemical Market Associates, Inc. 5 de diciembre de 2006. www.Cmaiglobal.com/marketing/... WLOA_WBA07.pdf


