8.12: Hielo y Agua
- Page ID
- 75822
El siguiente ejemplo más simple, y con mucho el más importante, de enlace de hidrógeno es el que ocurre en H 2 O. De nuevo hay evidencia clara de enlaces de hidrógeno en la estructura del sólido. La Figura 1 muestra dos diagramas dibujados por computadora de la red cristalina de hielo. En el modelo podemos ver claramente que cada átomo de O está rodeado por cuatro átomos de H dispuestos tetraédricamente. Dos de estos se encuentran a una distancia de 99 pm y están claramente unidos covalentemente al átomo de O. Los otros dos están a una distancia de 177pm.
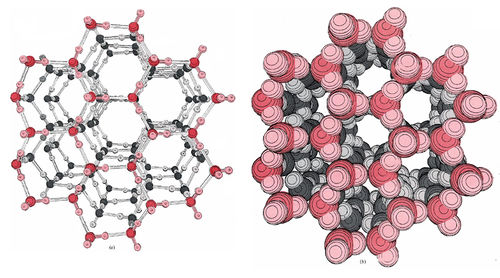
Están unidos covalentemente a otros átomos de O pero están unidos por hidrógeno al en cuestión. La situación es así:
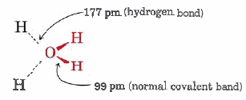
Al igual que en el caso de la HF, la distancia entre moléculas es anormalmente corta. La suma de los radios de van der Waals de H y O es de 260pm, considerablemente mayor que las 177pm observadas.
La orientación tetraédrica de los átomos de H alrededor de los átomos de O que resulta de la formación de enlaces de hidrógeno tiene un profundo efecto en las propiedades del hielo y del agua líquida. En el diagrama de llenado de espacio del hielo, la mayor parte de la densidad electrónica de cada átomo de H y O está encerrada por una superficie límite. Como puede ver, los enlaces de hidrógeno hacen que las moléculas H 2 O adopten una estructura bastante abierta con canales hexagonales que lo atraviesan. Estos canales contienen un vacío casi perfecto: en ellos hay una pequeña densidad de electrones de los átomos circundantes, pero nada más.
Cuando el hielo se derrite, algunos de los enlaces de hidrógeno se rompen y la rígida celosía cristalina colapsa un poco. Los canales hexagonales se llenan parcialmente y el volumen de una cantidad dada de H 2 O disminuye. Esta es la razón por la que el hielo es menos denso que el agua y flotará sobre él. A medida que la temperatura se eleva por encima de 0°C, se rompen más enlaces de hidrógeno, se ocupa más espacio vacío y el volumen continúa disminuyendo. En el momento en que se ha alcanzado 4°C, el aumento de las velocidades moleculares permite que cada molécula H 2 O empuje a sus vecinos más lejos. Esto contrarresta el efecto de romper los enlaces de hidrógeno, y el volumen de una cantidad dada de H 2 O comienza a aumentar con la temperatura.
La mayoría de los sólidos se expanden cuando se funden y los líquidos correspondientes se expanden continuamente al aumentar la temperatura, por lo que el comportamiento del agua es bastante inusual. También es sumamente importante en el medio ambiente. Cuando el agua se congela en pequeñas grietas en una roca, el mayor volumen del hielo puede dividir la roca en trozos más pequeños. Estos eventualmente llegan a ser capaces de soportar la vida de las plantas, y así el agua contribuye a la formación de suelo fértil. El mismo proceso le sucede a las carreteras, y es el motivo de nuevas grietas y baches que se ven en las carreteras después de un invierno frío. El experimento con bomba de hielo, que se ve a continuación, es quizás el ejemplo más dramático de expansión de agua cuando se congela.
En el video, se vierte agua en un recipiente de hierro fundido, que está herméticamente sellado. Luego, el recipiente se coloca en un lodo de acetona/hielo seco, que se encuentra a una temperatura de -77 °C. Después de un corto período de tiempo, el hielo se congela, se expande y hace que el recipiente de hierro fundido explote, volando la cubierta del baño de acetona/hielo seco y rociando el propio baño por todas partes. A pesar de que el recipiente de hierro fundido tenía lados de 1/8 de pulgada de espesor, la presión del hielo en expansión aún pudo destrozarlo.
Dado que el agua tiene una densidad máxima a 4°C, el agua a esa temperatura se hunde hasta el fondo de un lago profundo, proporcionando un ambiente relativamente uniforme durante todo el año. Si el hielo se hundiera hasta el fondo, como lo harían la mayoría de los líquidos congelantes, la superficie de un lago no estaría aislada del aire frío del invierno. El agua restante cristalizaría mucho más rápidamente de lo que realmente lo hace. En un mundo donde el hielo era más denso que el agua, los peces y otros organismos acuáticos tendrían que ser capaces de soportar la congelación durante largos periodos.
Los enlaces de hidrógeno también contribuyen a las cantidades anormalmente grandes de calor que se requieren para fundir, hervir o elevar la temperatura de una cantidad dada de agua. Se requiere energía térmica para romper los enlaces de hidrógeno así como para hacer que las moléculas de agua se muevan más rápido, y así una cantidad dada de calor eleva la temperatura de un gramo de agua menos que para casi cualquier otro líquido. Incluso a 100°C todavía hay muchos enlaces de hidrógeno ininterrumpidos, y se requiere casi 4 veces más calor para vaporizar un mol de agua de lo que se esperaría si no hubiera enlaces de hidrógeno. Este requerimiento de energía extra grande es la razón por la que el agua tiene un punto de ebullición más alto que cualquiera de los otros hidruros.
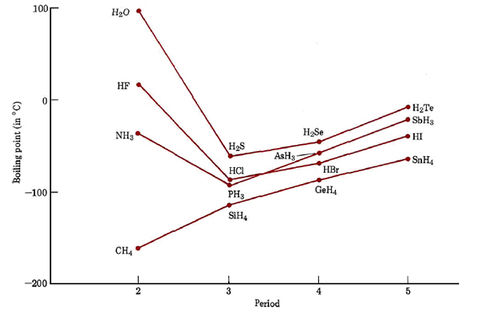
El hecho de que se necesita mucho calor para fundir, hervir, o aumentar la temperatura del agua, hace que este líquido sea ideal para transferir calor de un lugar a otro. El agua es utilizada por ingenieros en radiadores de automóviles, sistemas de calefacción de agua caliente y colectores de energía solar. Más significativamente, la circulación (en el torrente sanguíneo) y la evaporación (de la piel) del agua regulan la temperatura del cuerpo humano. (Se encuentra entre 55 y 65 por ciento de agua si es hembra y entre 65 y 75 por ciento de agua si es masculino.) Debido a esto (así como por muchas otras razones) el agua es un componente importante de los sistemas vivos. La capacidad del agua para almacenar energía térmica también es un factor importante que afecta el clima mundial. Las personas que viven cerca de grandes lagos u océanos experimentan fluctuaciones de temperatura menores entre el invierno y el verano que las que habitan en lugares como Siberia, a miles de kilómetros de una masa de agua considerable. Las corrientes oceánicas, como la Corriente del Golfo, transportan el calor de los trópicos a áreas que de otro modo serían bastante frías. Es interesante preguntarse, por ejemplo, si la civilización europea podría haberse desarrollado sin la ayuda del calor transportado por el común, pero altamente inusual, líquido-agua.


