8.15: Éteres
- Page ID
- 75687
En los alcoholes, uno de los dos enlaces al átomo de oxígeno involucra hidrógeno y uno involucra carbono. Sin embargo, cuando dos o más átomos de carbono están presentes, se hacen posibles estructuras isoméricas en las que el oxígeno está unido a dos carbonos diferentes. Tales compuestos se llaman éteres. Por ejemplo, el éter dimetílico es isomérico con etanol, y el éter metílico etílico es isomérico con propanol:
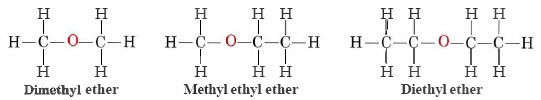
La fórmula general para un éter es R-O-R′, donde R' significa que ambos grupos R no necesitan ser iguales.
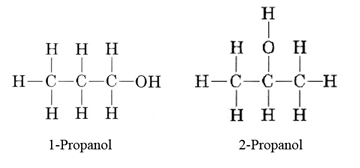
Dibuja fórmulas de proyección y nombra todos los isómeros que corresponden a la fórmula molecular C 3 H 8 O.
Solución La fórmula C 3 H 8 correspondería a un alcano. El átomo de oxígeno extra podría agregarse entre dos carbonos, dando éter, o podría agregarse entre un carbono y un hidrógeno, dando un alcohol. Las moléculas de alcohol pueden tener el grupo hidroxilo al final de la cadena de tres carbonos o en el segundo átomo de carbono:
 Solo es posible una estructura de éter, aquella en la que un grupo metilo y un grupo etilo están unidos al oxígeno:
Solo es posible una estructura de éter, aquella en la que un grupo metilo y un grupo etilo están unidos al oxígeno: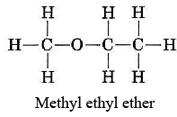
En un éter no hay átomos de hidrógeno conectados a un vecino altamente electronegativo, y así, a diferencia de los alcoholes, las moléculas de éter no pueden formar enlaces de hidrógeno entre sí. Cada enlace C-O es polar, pero los enlaces están aproximadamente en el ángulo tetraédrico. La polaridad de uno cancela parcialmente la polaridad del otro. En consecuencia, las fuerzas entre dos moléculas de éter no son mucho mayores que las fuerzas de Londres entre moléculas de alcano de tamaño comparable. El punto de ebullición del éter dimetílico, por ejemplo, es de —23°C, ligeramente por encima del del propano (—42°C), pero muy por debajo del del etanol (78.5°C). Las tres moléculas contienen 26 electrones y son aproximadamente del mismo tamaño. En la tabla de los puntos de ebullición de compuestos orgánicos comparables vemos nuevamente esta tendencia, esta vez con compuestos que contienen 32 o 34 electrones.
La reactividad química de los éteres también es más cercana a la de los alcanos que a la de los alcoholes. Los éteres experimentan pocas reacciones características distintas a la combustión, por lo que se utilizan comúnmente como solventes. También se usa éter dietílico como anestésico, aunque la inflamabilidad de su vapor requiere que se tomen precauciones para prevenir incendios.


