8.16: Aldehídos y Cetonas
- Page ID
- 75742
Beber metanol es dañino, no por las propias moléculas de CH 3 OH, sino porque el cuerpo humano convierte estas moléculas en moléculas de metanal (formaldehído) por combinación con oxígeno:
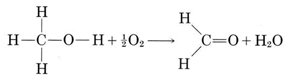
El formaldehído, H 2 CO, es muy reactivo, en estado puro puede combinarse explosivamente consigo mismo, formando moléculas mucho más grandes. En consecuencia se prepara comercialmente como una solución acuosa, la formalina, la cual contiene alrededor del 35 al 40 por ciento de H 2 CO. La formalina se elabora combinando metanol con aire a 550°C sobre un catalizador de plata o cobre. Se utiliza como conservante para especímenes biológicos, en líquidos de embalsamamiento, y como desinfectante e insecticida, no es una sustancia muy buena para introducir en tu cuerpo. El mayor uso comercial de formaldehído es la fabricación de baquelita, melamina y otros plásticos.
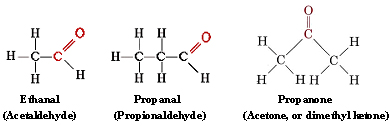
El grupo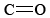 funcional que se encuentra en el formaldehído se denomina grupo carbonilo. Se pueden distinguir dos clases de compuestos sobre la base de la ubicación del grupo carbonilo. En los aldehídos se encuentra al final de una cadena carbonada y tiene al menos un hidrógeno unido. En las cetonas el grupo carbonilo está unido a dos átomos de carbono. Algunos ejemplos son
funcional que se encuentra en el formaldehído se denomina grupo carbonilo. Se pueden distinguir dos clases de compuestos sobre la base de la ubicación del grupo carbonilo. En los aldehídos se encuentra al final de una cadena carbonada y tiene al menos un hidrógeno unido. En las cetonas el grupo carbonilo está unido a dos átomos de carbono. Algunos ejemplos son
Se pueden realizar pruebas químicas para determinar la presencia de un grupo carbonilo. En el siguiente video, se agrega una solución de 2,4-dinitrofenilhidrazina a tubos de ensayo que contienen 2-propanol, un alcohol; 2-propanona (acetona), una cetona; y ácido propiónico un ácido carboxílico. La 2,4-dinitrofenilhidrazina solo reacciona con el grupo carbonilo de la 2-propanona, formando una naranja precipitar. La reacción que se produce es:
Otra prueba puede distinguir entre aldehídos y cetonas. Aquí un video de la Prueba de Tollens de Espejo Plateado para Aldehídos:
El reactivo Tollens es una solución acuosa de nitrato de plata, hidróxido de sodio y un poco de amoníaco. (En el video el amoníaco proviene de la reacción de iones amonio en nitrato de amonio e iones hidróxido de hidróxido de sodio para formar agua y NH 3.) Si se agrega un aldehído, en este caso, glucosa, a la solución, el Ag + se reduce por el aldehído, y el aldehído se oxida en un ácido carboxílico. Esto produce metal plateado, que recubre el matraz y crea el espejo. Una reacción similar no ocurre para las cetonas, por lo que solo los aldehídos producen el espejo de plata. La ecuación para la reacción en el video es:
Las terminaciones al y uno significan al dehído y ket uno, respectivamente. La fórmula general para un aldehído es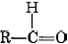 , mientras que para una cetona lo es
, mientras que para una cetona lo es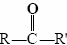 . Tenga en cuenta que cada cetona es isomérica con al menos un aldehído. La acetona, por ejemplo, tiene la misma fórmula molecular (C 3 H 6 O) que el propanal.
. Tenga en cuenta que cada cetona es isomérica con al menos un aldehído. La acetona, por ejemplo, tiene la misma fórmula molecular (C 3 H 6 O) que el propanal.
Las moléculas de aldehído y cetona no pueden formar enlaces de hidrógeno entre sí por la misma razón que los éteres no pueden, no contienen hidrógenos unidos a átomos altamente electronegativos. El grupo carbonilo es bastante polar, sin embargo, ya que la diferencia entre las electronegatividades del carbono (2.5) y el oxígeno (3.5) es bastante grande, y generalmente no hay otros dipolos en una molécula de aldehído o cetona para cancelar el efecto de C==O.
Por lo tanto, los puntos de ebullición de aldehídos y cetonas son intermedios entre los de alcanos o éteres por un lado y los alcoholes por otro. El acetaldehído, CH 3 CH 2 CHO, hierve a 20.8°C a medio camino entre propano (—42°C) y etanol (78.5°C). Los puntos de ebullición del propanal y la acetona se comparan con otros compuestos orgánicos en la tabla de los puntos de ebullición de compuestos orgánicos comparables lo que muestra la misma tendencia.
De todos los aldehídos y cetonas, el formaldehído y la acetona son de mayor importancia comercial. Ya se han mencionado usos del formaldehído. Al igual que otras cetonas, la acetona es principalmente útil como solvente, y es posible que la hayas usado para este propósito en el laboratorio. La acetona y otras cetonas son algo tóxicas y no deben manejarse descuidadamente.


