8.22: Dióxido de Silicio
- Page ID
- 75613
El dióxido de silicio, o sílice, (SiO 2) es otro ejemplo importante de un sólido macromolecular. La sílice puede existir en seis formas cristalinas diferentes. El más conocido de estos es el cuarzo, cuya estructura cristalina mostrada anteriormente se muestra nuevamente a continuación.
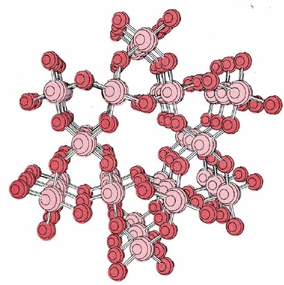
La arena consiste principalmente en pequeños fragmentos de cristales de cuarzo. El cuarzo tiene un punto de fusión muy alto, aunque no tan alto como el diamante.
Si vuelves a referirte a los ejemplos sobre silicio, puedes recordarte la razón por la que SiO 2 es macromolecular. El silicio es reacio a formar múltiples enlaces, por lo que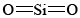 las moléculas discretas, análogas a
las moléculas discretas, análogas a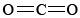 , no ocurren. Para satisfacer la valencia de silicio de 4 y la valencia de oxígeno de 2, cada silicio debe estar rodeado por cuatro oxígenos y cada oxígeno por dos siliconas. Esto se puede representar esquemáticamente por el diagrama de Lewis
, no ocurren. Para satisfacer la valencia de silicio de 4 y la valencia de oxígeno de 2, cada silicio debe estar rodeado por cuatro oxígenos y cada oxígeno por dos siliconas. Esto se puede representar esquemáticamente por el diagrama de Lewis


