8.21: Diamante y Grafito
- Page ID
- 75700
El ejemplo más simple de un sólido macromolecular es el diamante. Los cristales de diamante contienen solo átomos de carbono, y estos están unidos entre sí por enlaces covalentes en una red tridimensional gigante, como se muestra a continuación. Observe cómo cada átomo de carbono está rodeado tetraédricamente por cuatro enlaces.
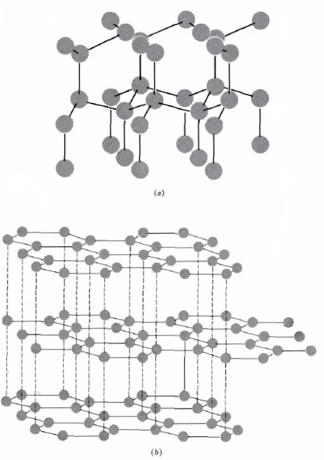
Dicha red de átomos de carbono se extiende por todo el cristal de manera que todo el diamante es una entidad unida covalentemente extremadamente grande, es decir, una macromolécula.
Debido a que los fuertes enlaces covalentes, en lugar de las fuerzas de Londres o las fuerzas dipolares, mantienen unidos los átomos de carbono en este cristal, se necesita una gran cantidad de energía para separarlos. En consecuencia, el diamante tiene un punto de fusión extremadamente alto, 3550°C, mucho más alto que cualquier sólido iónico. El diamante es también la sustancia más dura conocida. Cada átomo de carbono se mantiene firmemente en su lugar desde todos los lados y, por lo tanto, es muy difícil de desplazar o eliminar.
El carbono también existe en una segunda forma cristalina, más familiar, llamada grafito, cuya estructura cristalina también se muestra en la parte b de la figura. Usas grafito cada vez que escribes con un lápiz. (¡Las minas de lápiz consisten en C, no Pb!) La estructura del grafito consiste en capas planas. En cada capa los átomos de carbono están dispuestos en una matriz hexagonal regular. Podemos considerar cada capa como un gran número de anillos de benceno fusionados para formar un panal gigantesco. Todos los enlaces carbono-carbono en este panal son equivalentes y de carácter intermedio entre un enlace simple y uno doble.
Si bien existen fuertes enlaces covalentes entre los átomos de carbono en un plano dado, solo las fuerzas débiles de Londres atraen a los aviones juntos. Por lo tanto, las diversas capas pueden deslizarse unas junto a otras con bastante facilidad. Cuando una mina de lápiz se frota sobre el papel, los planos se deslizan uno junto al otro y se dejan placas delgadas de cristal en el papel. Estas placas deslizantes también hacen que el grafito sea útil como lubricante.
Cuando un elemento puede existir en más de una forma cristalina, como la lata de carbono en diamante y grafito, se dice que cada forma es un alótropo. Otros elementos, como el azufre y el fósforo, también forman alótropos.


