9.18: Desviaciones de la Ley de Gas Ideal
- Page ID
- 75311
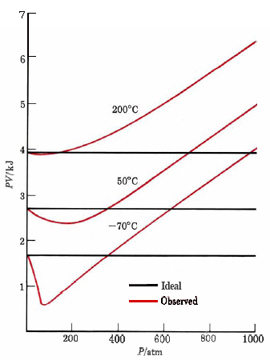
La medición suficientemente precisa de la presión, la temperatura, el volumen y la cantidad de cualquier gas revelará que la ley de gas ideal nunca se obedece exactamente. Es por ello que los volúmenes molares del Cuadro 1 de la Ley de Avagodro no fueron todos exactamente 22.414 litros. Una manera conveniente de detectar desviaciones de la ley de gas ideal es calcular PV bajo diversas condiciones. Según la teoría cinética, PV es dos tercios de la energía cinética molecular total y debe permanecer constante a una temperatura dada para una cantidad dada de gas. Que no es evidente a partir de la Figura\(\PageIndex{1}\), donde se grafica PV para 1 mol CH 4 (g) versus P. A altas presiones, la PV siempre es mayor de lo que predice la ley de gas ideal. A medida que la temperatura disminuye, las desviaciones ocurren a presiones más bajas, y el PV cae por debajo de la línea horizontal predicha antes de subir nuevamente con la presión.
A altas presiones, el PV aumenta por encima del valor ideal del gas debido a que el primer postulado de la teoría cinética de los gases ya no es válido. A medida que aumenta la presión, las moléculas se aprietan cerca una de la otra, y el volumen de las mismas moléculas se convierte en una fracción significativa del volumen del recipiente. Esto se muestra en la Figura\(\PageIndex{2}\). El espacio que se impide que ocupen otras moléculas se denomina volumen excluido. El volumen medido del contenedor, contenedor V, es la suma del volumen disponible para las moléculas de gas, gas V, y este volumen excluido. Dado que el contenedor PV es más grande que el gas fotovoltaico, el PV medido experimentalmente es demasiado grande.
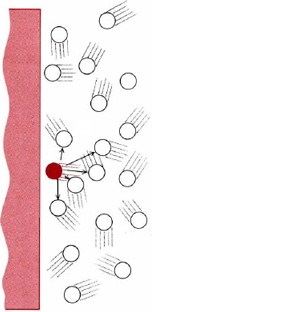
Las fuerzas intermoleculares hacen que la PV caiga por debajo de la predicción de gas ideal a bajas temperaturas y presiones medias. Considera una molécula de gas que está a punto de chocar contra la pared del contenedor (Figura\(\PageIndex{3}\)). La teoría cinética asume que sus vecinos no ejercen ninguna fuerza sobre dicha molécula excepto durante una colisión (postulado 5), pero sabemos que tales fuerzas existen.

Cuando una molécula está cerca de la pared, las atracciones entre ésta y sus vecinos están desequilibradas, tendiendo a alejarla de la pared. La molécula produce un impacto ligeramente menor que si no hubiera fuerzas intermoleculares. Todas las colisiones con las paredes son más suaves, y la presión es menor de lo que prediría la ley de gas ideal. Este efecto de las fuerzas intermoleculares es más pronunciado a temperaturas más bajas porque bajo esas condiciones las energías cinéticas de las moléculas son menores. La energía potencial de atracción intermolecular es comparable a esa energía cinética y puede tener un efecto significativo.
Para gases como hidrógeno, oxígeno, nitrógeno, helio o neón, las desviaciones de la ley de gases ideales son menores de 0.1 por ciento a temperatura ambiente y presión atmosférica. Otros gases, como el dióxido de carbono o el amoníaco, tienen fuerzas intermoleculares más fuertes y en consecuencia una mayor desviación de la idealidad. El comportamiento no ideal es bastante pronunciado para cualquier gas a presiones muy altas o a temperaturas justo por encima del punto de ebullición. Bajo estas condiciones, el volumen molecular o las atracciones intermoleculares pueden tener el máximo efecto.


