11.2: Iones en Solución (Electrolitos)
- Page ID
- 74996
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
En Compuestos iónicos binarios y sus propiedades señalamos que cuando un compuesto iónico se disuelve en agua, los iones positivos y negativos originalmente presentes en la red cristalina persisten en solución. Su capacidad para moverse casi independientemente a través de la solución les permite llevar cargas eléctricas positivas o negativas de un lugar a otro. De ahí que la solución conduzca una corriente eléctrica.
Electrolitos
Las sustancias cuyas soluciones conducen la electricidad se llaman electrolitos. Todos los compuestos iónicos solubles son electrolitos fuertes. Conducen muy bien porque proporcionan un suministro abundante de iones en solución. Algunos compuestos covalentes polares también son electrolitos fuertes. Ejemplos comunes son HCl, HBr, HI y H 2 SO 4, todos los cuales reaccionan con H 2 O para formar grandes concentraciones de iones. Una solución de HCl, por ejemplo, conduce incluso mejor que una de NaCl que tiene la misma concentración.
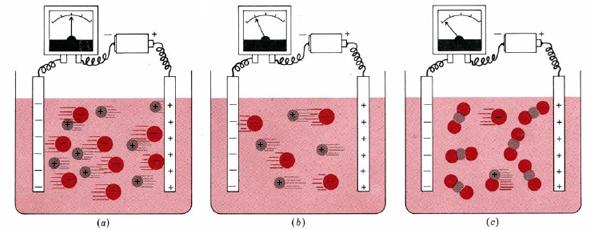
El efecto de la concentración de iones sobre la corriente eléctrica que fluye a través de una solución se ilustra en la Figura\(\PageIndex{1}\). La parte a de la figura muestra lo que sucede cuando una batería se conecta a través de un medidor eléctrico a dos tiras de metal inerte (electrodos) sumergiendo en etanol. Cada decímetro cúbico de dicha solución contiene 0.10 mol de NaCl (es decir, 0.10 mol Na + y 0.10 mol Cl —). Una corriente eléctrica es transportada a través de la solución tanto por los iones Na + que se mueven hacia el electrodo negativo como por los iones Cl - que son atraídos hacia el electrodo positivo. El dial en el medidor indica la cantidad de corriente.
La Figura 1 b muestra que si reemplazamos la solución de NaCl 0.10- M por una solución de NaCl 0.05- M, la lectura del medidor cae a aproximadamente la mitad de su valor anterior. Al reducir a la mitad la concentración de NaCl se reduce a la mitad el número de iones entre los electrodos, y la mitad de iones solo puede llevar la mitad de carga eléctrica. Por lo tanto la corriente es la mitad de grande. Debido a que responde de manera tan directa a la concentración de iones, la conductividad de la corriente eléctrica es una herramienta útil en el estudio de soluciones.
Las mediciones de conductividad revelan que la mayoría de los compuestos covalentes, si se disuelven en agua, conservan sus estructuras moleculares originales. Las moléculas neutras no pueden transportar cargas eléctricas a través de la solución, por lo que no fluye corriente. Una sustancia cuya solución acuosa no conduce mejor que el agua misma se llama no electrolito. Algunos ejemplos son oxígeno, O 2, etanol, C 2 H 5 OH, y azúcar, C 12 H 22 O 11.

Algunas sustancias covalentes se comportan como electrolitos débiles, sus soluciones solo permiten un pequeño flujo de corriente, pero es mayor que el del solvente puro. Un ejemplo es el cloruro de mercurio (II) (visto en la Figura anterior). Para una solución 100- M de HgCl 2, la lectura del medidor muestra solo aproximadamente 0.2 por ciento tanto de corriente como para NaCl 0.10 M. Un cristal de HgCl 2 consiste en moléculas discretas, como las que se muestran para HGbR 2 en la Figura\(\PageIndex{2}\). Cuando el sólido se disuelve, la mayoría de estas moléculas permanecen intactas, pero algunas se disocian en iones según la ecuación
\[ \underbrace{HgCl_2}_{99.8\%} \rightleftharpoons \underbrace{HgCl^+}_{0.2\%} + Cl^- \nonumber \]
(Las flechas dobles indican que la ionización procede sólo en un grado limitado y se alcanza un estado de equilibrio). Dado que solo 0.2 por ciento del HgCl 2 forma iones, la solución 0.10 M puede conducir solo aproximadamente 0.2 por ciento tanto de corriente como NaCl 0.10 M.
Las mediciones de conductividad pueden decirnos más que si una sustancia es fuerte, débil o no electrolítica. Consideremos, por ejemplo, los datos en la Tabla\(\PageIndex{1}\) que muestra la corriente eléctrica conducida a través de diversas soluciones acuosas en idénticas condiciones. A la concentración bastante baja de 0.001 M, las soluciones electrolíticas fuertes conducen entre 2500 y 10 000 veces más corriente que H 2 O puro y aproximadamente 10 veces más que los electrolitos débiles HC 2 H 3 O 2 (ácido acético) y NH 3 ( amoníaco).
Un examen más detallado de los datos para detectar electrolitos fuertes revela que algunos compuestos que contienen grupos H u OH [como HCl o Ba (OH) 2] conducen inusualmente bien. Si se excluyen estos compuestos, encontramos que 1:1 electrolitos (compuestos que consisten en números iguales de +1 iones y —1 iones) generalmente conducen aproximadamente la mitad de corriente que 2:2 electrolitos (+2 y -2 iones), 1:2 electrolitos (+1 y -2 iones), o 2:1 electrolitos (+2 y -1 iones).
| Sustancia | Corriente /mA | Sustancia | Corriente /mA |
|---|---|---|---|
| Agua Pura | 1:2 Electrolitos | ||
| H 2 O | 3.69 x 10 -4 | Na 2 SO 4 | 2.134 |
| Electrolitos Débiles | Na 2 CO 3 | 2.24 | |
| HC 2 H 3 O 2 | 0.41 | K 2 CO 3 | 2.660 |
| NH 3 | 0.28 | 2:1 Electrolitos | |
| Electrolitos 1:1 | MgCl 2 | 2.128 | |
| NaCl | 1.065 | CaCl 2 | 2.239 |
| NaI | 1.069 | SrCl 2 | 2.290 |
| KCl | 1.273 | BaCl 2 | 2.312 |
| KI | 1,282 | Ba (OH) 2 | 4.14 |
| AgnO | 1.131 | 2:2 Electrolitos | |
| HCl | 3.77 | MgSO 4 | 2.00 |
| HNO 3 | 3.75 | CaSO 4 | 2.086 |
| NaOH | 2.08 | CuSO 4 | 1.97 |
| KOH | 2.34 | ZnSO 4 | 1.97 |
* Todas las mediciones se refieren a un cel1 en el que la distancia entre los electrodos es de 1.0 mm y el área de cada electrodo es de 1.0 cm². Se aplica una diferencia de potencial de 1.0 V para producir las corrientes tabuladas.
Hay una razón simple para este comportamiento. En condiciones similares, la mayoría de los iones se mueven a través del agua a velocidades comparables. Esto significa que iones como Mg 2+ o SO 4 2—, que están doblemente cargados, transportarán el doble de corriente a través de la solución que los iones cargados individualmente como Na + o Cl —. En consecuencia, una solución 0.001 M de un electrolito 2:2 como MgSO 4 conducirá aproximadamente dos veces así como una solución 0.001 M de un electrolito 1:1 como NaCl.
Un argumento similar se aplica a soluciones de electrolitos 1:2 y 2:1. Una solución como 0.001 M Na 2 SO 4 conduce aproximadamente el doble de NaCl 0.001 M en parte porque hay el doble de iones Na disponibles para moverse cuando una batería está conectada, pero también porque los iones SO 4 2— llevan el doble de mucha carga como iones Cl — cuando se mueve a la misma velocidad. Estas diferencias en la conductividad entre diferentes tipos de electrolitos fuertes a veces pueden ser muy útiles para decidir qué iones están realmente presentes en una solución electrolítica dada como deja claro el siguiente ejemplo.
Una segunda conclusión, un poco más sutil, puede extraerse de los datos de la Tabla\(\PageIndex{1}\). Cuando un electrolito se disuelve, cada tipo de ion hace una contribución independiente a la corriente que conduce la solución. Esto se puede observar comparando NaCl con KCl, y NaI con KI. En cada caso el compuesto que contiene K + conduce aproximadamente 0.2 mA más que el que contiene Na +. Si aplicamos esta observación a Na 2 CO 3 y K 2 CO 3, cada uno de los cuales produce el doble de iones Na + o K + en solución, encontramos que la diferencia de corriente también es el doble de grande, aproximadamente 0.4 mA.
Así, las mediciones de conductividad confirman nuestra afirmación de que cada ion exhibe sus propias propiedades características en soluciones acuosas, independientemente de la presencia de otros iones. Una de esas propiedades características es la cantidad de corriente eléctrica que puede llevar una concentración dada de un cierto tipo de ion.
A 18°C una solución acuosa 0.001- M de hidrogenocarbonato de potasio, KHCO 3, conduce una corriente de 1.10 mA en una celda del mismo diseño que la utilizada para obtener los datos del Cuadro 11.1. ¿Qué iones están presentes en solución?
Solución
Haciendo referencia a la Tabla 6.2 que enumera posibles iones poliatómicos, podemos llegar a tres posibilidades para los iones de los que está hecho KHCO 3:
- K + y H + y C 4+ y tres O 2—
- K + y H + y CO 3 2—
- K + y HCO 3 —
Dado que la corriente conducida por la solución cae en el rango de 1.0 a 1.3 mA característico de electrolitos 1:1, la posibilidad c es la única opción razonable.


