13.10: El efecto de un cambio en la presión
- Page ID
- 75146
Como ejemplo de la aplicación del principio de Le Chatelier, considere el efecto de triplicar la presión sobre una mezcla de equilibrio de NO 2 y N 2 O 4:
\[\text{N}_2\text{O}_4(g) \rightleftharpoons \text{2NO}_2(g) \label{1} \]
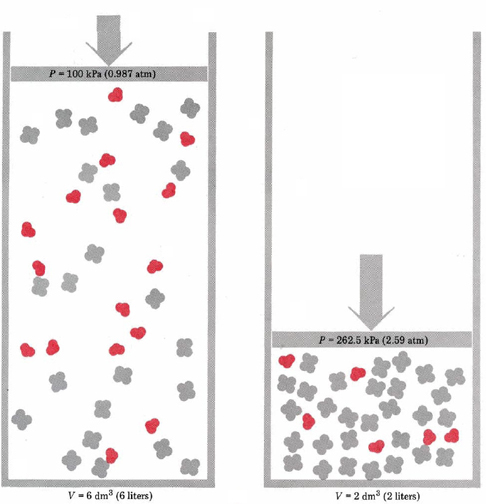
Esto se podría hacer usando el pistón y el cilindro mostrados en la Figura\(\PageIndex{1}\), en cuyo caso se esperaría que triplicar la presión redujera el volumen de la mezcla a un tercio de su valor anterior. Bajo las nuevas condiciones, sin embargo, el principio de Le Chatelier nos dice que se logrará un nuevo equilibrio que contrarresta la alteración de la presión. Es decir, las concentraciones de N 2 O 4 y NO 2 deben cambiar de tal manera que disminuya el aumento de presión. Esto puede suceder si parte del NO 2 reacciona para formar N 2 O 4 porque se consumen dos moléculas de NO 2 por cada molécula de N 2 O 4 producida. Esta reducción en el número de moléculas de gas reducirá la presión en el nuevo volumen. Así, el principio de Le Chatelier predice que\(\ref{1}\) ocurrirá lo contrario de la Ecuación, produciendo más N 2 O 4 y consumiendo algo de NO 2. Decimos que aumentar la presión sobre los N 2 O 4 y NO 2 provoca que el equilibrio se desplace hacia la izquierda. Esto concuerda con los datos experimentales sobre este equilibrio, ya dados en el Cuadro 2 en La Constante de Equilibrio. Obsérvese que el valor de la constante de equilibrio sigue siendo el mismo, aunque el equilibrio cambie.
Observe que el efecto recién descrito ocurre porque el volumen de gas disminuyó y las concentraciones de NO 2 y N 2 O 4 aumentaron ambas. Si hubiéramos aumentado la presión total sobre el sistema de equilibrio bombeando en un gas inerte como N 2 (g), el volumen habría permanecido igual, al igual que las presiones parciales y concentraciones de NO 2 y N 2 O 4. En tal caso no se esperaría ningún cambio en el equilibrio. Anote también las palabras si es posible en la declaración del principio de Le Chatelier. Si la reacción de equilibrio no hubiera implicado un cambio en el número de moléculas en la fase gaseosa, ningún cambio en las concentraciones podría haber hecho alguna diferencia en la presión. Así, para la reacción
\[\text{2HI}(g) \rightleftharpoons \text{H}_2(g) + \text{I}_2(g) \nonumber \]
cambiar la presión cambiando el tamaño del contenedor no tendría ningún efecto. Puedes comprobarlo tú mismo rehaciendo el Ejemplo 1 de Calcular la extensión de una reacción usando varios volúmenes diferentes y la misma cantidad inicial de HI.
En general, siempre que un equilibrio gaseoso implique un cambio en el número de moléculas (Δn ≠ 0), aumentar la presión al reducir el volumen desplazará el equilibrio en la dirección de menos moléculas. Esto aplica incluso si están involucrados líquidos puros o sólidos en la reacción. Un ejemplo es la reacción
\[\text{C}(s) + \text{H}_2\text{O}(g) \rightleftharpoons \text{CO}(g) + \text{H}_2(g) \nonumber \]
en el que el vapor sobrecalentado pasa sobre el carbono obtenido del carbón para producir monóxido de carbono e hidrógeno. Dado que el volumen de carbono sólido es despreciable en comparación con los volúmenes de los gases, solo hay que considerar estos últimos. De ahí Δn = 1 (dos moléculas de gas a la derecha por cada una de la izquierda), y un aumento en la presión debería favorecer la reacción inversa. Esta reacción es un proceso industrial importante, y por la razón que acabamos de esbozar, se lleva a cabo a baja presión.
El siguiente video demuestra cómo es este proceso, utilizando una vez más la reacción de N 2 O 4 y NO 2. Aquí vemos confirmación visual de que un aumento en el volumen de un contenedor provoca un desplazamiento en el equilibrio basado en el número de moles de gas, según el principio de Le Chatelier.


