20.5: Lípidos no polares
- Page ID
- 75114
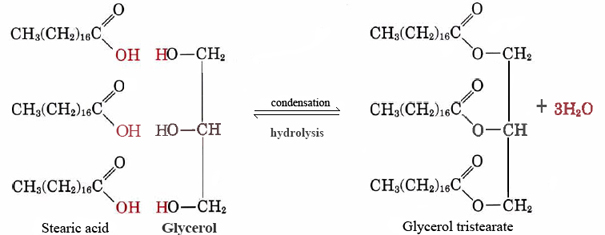
Un buen ejemplo de un lípido no polar es el triestearato de glicerol graso neutro. Esta forma más común de grasa animal sirve como almacén de energía y como aislamiento contra la pérdida de calor. A nivel molecular se construye a partir de tres moléculas de ácido esteárico y una de glicerol:
 (1)
(1)
Observe que por cada molécula esteárico u otra molécula de ácido graso que se combina con uno de los grupos —OH del glicerol, se desprende una molécula de agua, por lo que la reacción es una condensación. Resulta que una gran cantidad de moléculas biológicas importantes se juntan por reacciones de condensación durante las cuales se desprende agua. El reverso de la Ec. (1), en el que el agua reacciona con una molécula grande y la divide en trozos más pequeños, se llama hidrólisis. Al llevar a cabo la hidrólisis, los organismos vivos pueden descomponer moléculas fabricadas por otras especies. Los simples bloques de construcción obtenidos de esta manera pueden ser recombinados por reacciones de condensación para formar estructuras apropiadas para su nuevo huésped.
En contraste con el triestearato de glicerol que se encuentra en los animales, las grasas vegetales contienen numerosos dobles enlaces en sus largas cadenas de hidrocarburos. Esta poliinsaturación introduce “torceduras” en las cadenas de hidrocarburos debido a la barrera a la rotación y los ángulos de 120° asociados con los dobles enlaces. En consecuencia, es más difícil alinear las cadenas una al lado de la otra (ver Figura \(\PageIndex{1}\)), y las grasas insaturadas no se empaquetan tan fácilmente en una red cristalina. Como sucedió con los alcanos, la longitud de la cadena también determina si una grasa es líquida o sólida, y dónde ocurre el punto de fusión.
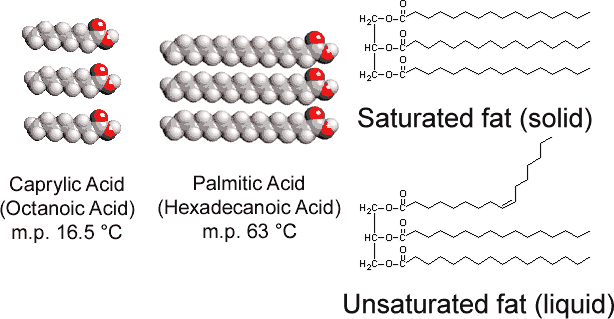
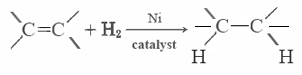
La mayoría de las grasas insaturadas (como el aceite de maíz) son líquidas a temperaturas ordinarias, mientras que las grasas saturadas (como la mantequilla) son sólidas. Los aceites vegetales se pueden convertir por hidrogenación en compuestos que son sólidos. Este proceso implica añadir H 2 catalíticamente a los dobles enlaces:
La hidrólisis de las grasas [el reverso de la Ec. (1)] es importante en la fabricación de jabones. Se puede agilizar mediante la adición de una base fuerte como NaOH o KOH, en cuyo caso la reacción se denomina saponificación. Dado que la saponificación requiere que el pH de la mezcla de reacción sea alto, el ácido graso que se produce se disociará a su anión. Cuando el triestearato de glicerol se saponifica con NaOH por ejemplo, se forma estearato de sodio, una sustancia relativamente soluble en agua y un jabón común.
La capacidad de los jabones para limpiar la grasa y el aceite de las superficies sucias es el resultado de las estructuras duales hidrófobas-hidrófilas de sus moléculas. El ion estearato, por ejemplo, consiste en una larga cadena hidrocarbonada no polar con un grupo altamente polar —COO — en un extremo.
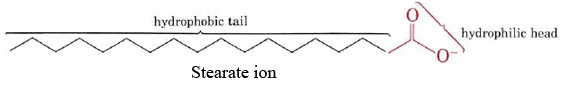
La cadena hidrocarbonada hidrofóbica intenta evitar el contacto con medios acuosos, mientras que el grupo aniónico acomoda fácilmente las atracciones dipolares y los enlaces de hidrógeno de las moléculas de agua.
Las dos formas principales en que las porciones hidrófobas de los iones estearato pueden evitar el agua son agruparse en la superficie o disolverse en una pequeña cantidad de aceite o grasa (ver Figura \(\PageIndex{2}\)).
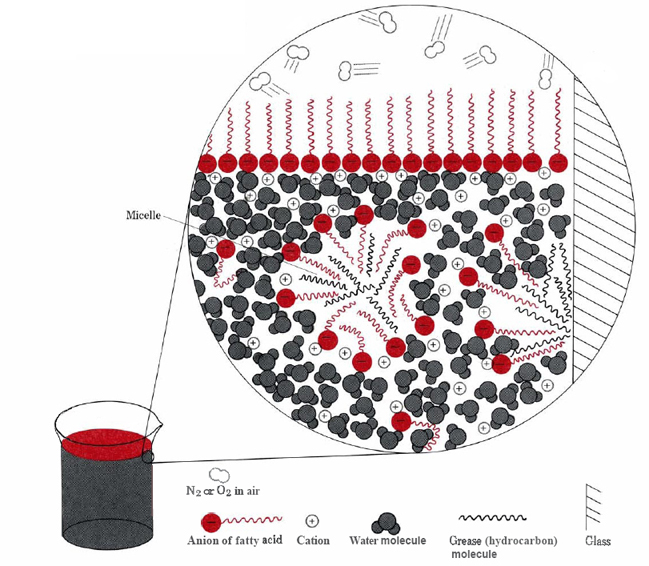
En este último caso las cabezas hidrófilas de las moléculas de jabón entran en contacto con el agua fuera de la grasa, formando una estructura conocida como micela. Dado que los exteriores de las micelas están cargados negativamente, se repelen entre sí y evitan que las gotas de grasa se recombinen. Por lo tanto, la grasa se suspende (emulsiona) en el agua y se puede lavar fácilmente.
Los jabones naturales, como el estearato de sodio, se elaboraron originalmente en el hogar calentando grasa animal con cenizas de madera, que contenían potasa, K 2 CO 3. Todavía se producen grandes cantidades industrialmente, pero en gran medida los jabones han sido reemplazados por detergentes. Esto es consecuencia del comportamiento indeseable de los jabones en aguas duras. El calcio, magnesio y otros cationes de agua dura forman compuestos insolubles cuando se combinan con los aniones de los ácidos grasos. Esto produce precipitados espumosos y evita que las moléculas de jabón emulsionen grasa a menos que se use un gran exceso.
Los detergentes como los alquilbencenosulfonatos (ABS) y los alquilbencenosulfonatos lineales (LAS) tienen estructuras muy similares al estearato de sodio excepto que el grupo cargado en sus cabezas hidrófilas es —SO 3 — unido a un anillo de benceno. Los detergentes ABS también tienen grupos metilo (CH 3) que ramifican sus cadenas de hidrocarburos.
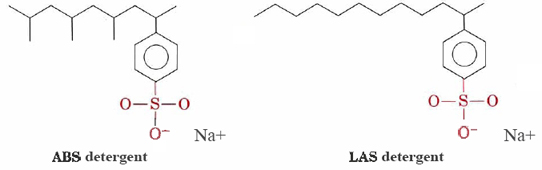
Tales moléculas no precipitan con cationes de agua dura y por lo tanto son más adecuadas para el lavado a máquina de ropa. Los detergentes LAS sustituyeron al ABS a mediados de los años sesenta cuando se descubrió que estos últimos no eran biodegradables. Estaban provocando que los ríos e incluso el agua del grifo se cubrieran de jabonaduras detergentes y espuma. Al parecer, las enzimas en microorganismos que habían evolucionado para descomponer las cadenas hidrocarbonadas no ramificadas en grasas naturales y ácidos grasos fueron incapaces de digerir las cadenas ramificadas de moléculas de ABS. Los detergentes LAS, aunque fabricados por humanos, imitan las estructuras de moléculas naturales y son biodegradables.


