21.3: Los espectros atómicos y la teoría de Bohr
- Page ID
- 75230
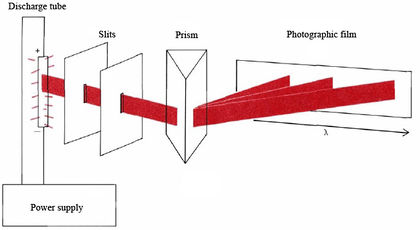
Si el espectro de emisión de un elemento se pasa a través de un prisma y se deja que golpee una película fotográfica, se puede medir la intensidad de emisión en función de la longitud de onda. El equipo para realizar tales mediciones se denomina espectroscopio y se muestra esquemáticamente en la Figura\(\PageIndex{1}\). Los espectros de emisión típicos obtenidos de esta manera se muestran en la Figura\(\PageIndex{2}\) donde se representa la intensidad frente a la longitud de onda. Observe a partir de esta figura cómo la luz emitida se limita a unas pocas longitudes de onda muy específicas. En todas las demás longitudes de onda no hay emisión en absoluto. Los espectros de este tipo generalmente se denominan espectros de línea. Las longitudes de onda de las líneas en un espectro lineal son únicas para cada elemento y a menudo se utilizan, especialmente en metalurgia, tanto para identificar un elemento como para medir la cantidad presente. Estas longitudes de onda a menudo se pueden medir con una precisión tan grande como una parte en mil millones (1 en 10 9). Debido a que el espectro de un elemento es fácilmente reproducible y se puede medir con tanta precisión, a menudo se usa para determinar longitudes. Por ejemplo, el medidor alguna vez se definió como la distancia entre dos marcas en una barra de platino mantenida en Sevrés en Francia, pero ahora se toma como 1 650 763.73 longitudes de onda de una línea particular en el espectro de 86 Kr.
A primera vista las longitudes de onda de las líneas en un espectro de emisión, como las que se muestran en la Figura\(\PageIndex{2}\), parecen no tener patrón para ellas, pero al estudiar más a fondo se pueden distinguir las regularidades.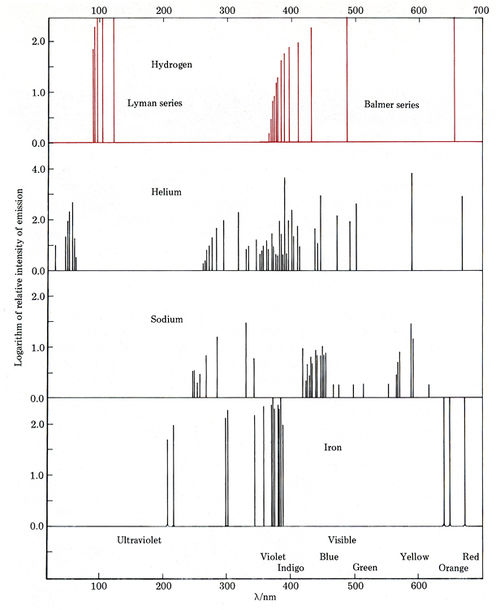
Por ejemplo, puede ver que las líneas en el espectro de hidrógeno ocurren muy juntas en la región justo por encima de 365 nm y luego se separan cada vez más a medida que λ aumenta. En 1885 un profesor suizo de matemáticas de secundaria, J. J. Balmer (1825 a 1898), descubrió una fórmula que explicaba esta regularidad:
-
- \[\lambda=364.6 \text{ nm}\frac{n^{2}}{n^{2}-4} ~~~~ n = 3, 4, 5, \cdots \label{1} \]
Otras series similares de líneas se encuentran en las regiones ultravioleta (serie Lyman) e infrarroja (Paschen, Brackett, serie Pfund) del espectro. En cada caso, las longitudes de onda de las líneas se pueden predecir mediante una ecuación similar en forma a la de Balmer, las cuales fueron combinadas por Rydberg en la forma general
-
- \[\frac{1}{\lambda}=R_{\infty}\big(\frac{1}{n_{1}^{2}}-\frac{1}{n_{2}^{2}}\big) ~~~~~~ n_2 \text{>} n_1 \label{2} \]


