21.5: El Espectro de Moléculas- Infrarrojos
- Page ID
- 75259
Cuando pasamos de los espectros de átomos a los de las moléculas, encontramos que la región de mayor interés para los químicos ya no es la visible y ultravioleta sino la infrarroja. Como su nombre lo indica, el infrarrojo se extiende más allá del extremo rojo del espectro visible, desde el límite de visibilidad a aproximadamente 0.8 μm (800 nm) hasta aproximadamente 100 μm donde comienza la región de microondas. Otra diferencia con los espectros discutidos en la sección de espectros atómicos es que los espectros infrarrojos son todos espectros de absorción más que espectros de emisión La luz infrarroja pasa a través de la muestra, y la intensidad de la luz emergente se mide electrónicamente. Las energías de los fotones infrarrojos son mucho menores que las de los fotones visibles y ultravioletas. Un fotón de longitud de onda de 10 μm tiene una energía de solo 0.02 aJ (aproximadamente 12 kJ m —1), ni siquiera suficiente para romper un enlace de hidrógeno, y mucho menos un enlace covalente normal. Sin embargo, sí tiene suficiente energía para hacer que una molécula vibre más fuertemente y como la energía vibratoria se cuantifica, esto sólo puede suceder a ciertas frecuencias discretas y no a otras.
La Figura 1 muestra los espectros infrarrojos de dos moléculas triatómicas, H 2 O y CO 2, y también el de una molécula más compleja, C 2H 5 OH (etanol). Cada uno de los picos en estos espectros corresponde a una fuerte absorción de radiación infrarroja a nivel macroscópico y un aumento repentino en la amplitud con la que la molécula vibra a nivel microscópico. Dado que una molécula poliatómica puede vibrar de diversas maneras, hay varios picos para cada molécula. Cuanto más compleja es la molécula, mayor es el número de picos. Tenga en cuenta también que no todas las vibraciones corresponden al estiramiento y no estiramiento de los enlaces. Una vibración en una molécula poliatómica se define como cualquier movimiento periódico que cambia la forma o el tamaño de la molécula. En este sentido, los movimientos de flexión y torsión también cuentan como vibraciones.
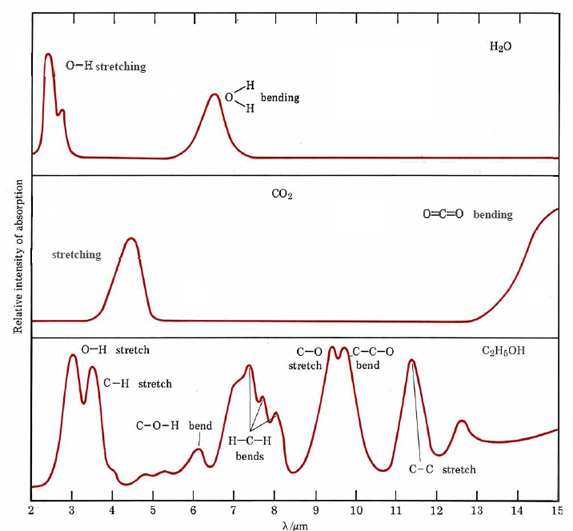
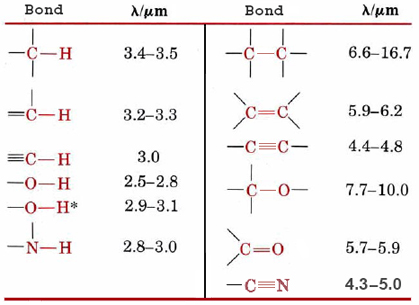
Una característica útil de las vibraciones que ocurren en las moléculas poliatómicas es que muchos enlaces y algunos pequeños grupos de átomos vibran de la misma manera sin importar en qué molécula se encuentren. En la Figura 1, por ejemplo, el estiramiento del enlace O-H da un pico entre 2 y 3 μm tanto para H 2 O como para C 2 H 5 OH. Debido a esto es posible identificar muchos de los grupos funcionales en una molécula orgánica simplemente observando su espectro infrarrojo. La figura\(\PageIndex{2}\) muestra longitudes de onda características mediante las cuales se pueden identificar algunos grupos funcionales comunes. Por otro lado, cada molécula es una combinación única de enlaces químicos y grupos funcionales. Las diferencias bastante menores en la estructura molecular pueden resultar en diferencias notables en el espectro infrarrojo. Así estos espectros pueden ser utilizados de la misma manera que la policía usa huellas dactilares.
Cuando se prepara un compuesto desconocido, una de las primeras cosas que suele medirse es su espectro infrarrojo. Si este espectro coincide con el de un compuesto previamente preparado, el compuesto desconocido puede identificarse fácilmente. De no ser así, aún puede ser posible identificar algunos de los grupos funcionales que están presentes.
Para que una vibración molecular interactúe con la radiación electromagnética, el momento dipolar de la molécula debe cambiar a medida que se produce la vibración. Cuanto mayor sea este cambio en el momento dipolar, más fuertemente absorberá la sustancia la radiación incidente. Así, los enlaces muy polares como O-H y C==O suelen producir picos muy prominentes en un espectro infrarrojo. Por el contrario, algunas vibraciones no aparecen en absoluto en el infrarrojo. En particular, las moléculas diatómicas como N 2 y O 2, en las que ambos átomos son idénticos, tienen momento dipolar cero en cualquier etapa en una vibración. No producen absorción en el infrarrojo.
Dado que N 2 y O 2, son los principales constituyentes del aire, es igual de bien que no absorban la radiación infrarroja. ¡El ambiente se volvería intolerablemente caliente si lo hicieran! Tal como está, sólo los constituyentes menores de la atmósfera, CO 2 y H 2 O, absorben en el infrarrojo. Sin embargo, esta absorción aún juega un papel importante en el mantenimiento de la superficie de la tierra a su temperatura actual.
La tierra absorbe energía del sol durante el día, e irradia esta energía por la noche. El flujo de entrada y salida deben equilibrarse en promedio, de lo contrario la tierra se calentaría o enfriaría. La mayor parte de la radiación solar se encuentra en la región visible del espectro, pero la radiación que escapa de la tierra mucho más fría se encuentra principalmente en el infrarrojo, centrada alrededor de 10 a 12 μm. Como puede ver en la Figura\(\PageIndex{1}\), el agua absorbe radiación infrarroja entre 2 a 3 μm y 6 a 7.5 μm. El agua también absorbe fuertemente por encima de 18 μm. Así, gran parte de la radiación infrarroja saliente es absorbida por el vapor de agua en la atmósfera terrestre y se evita que escape. Es posible que hayas notado que después de un día de verano realmente húmedo la temperatura no baja muy rápido por la noche. El exceso de vapor de agua en la atmósfera evita que la radiación escape de la superficie terrestre. Por otro lado, en una zona desértica la baja humedad permite una rápida pérdida de calor. Aunque las rocas pueden calentarse lo suficiente como para freír un huevo por día, las temperaturas suelen bajar a congelarse durante la noche. Si bien las concentraciones locales de vapor de agua pueden variar de vez en cuando, la cantidad total en la atmósfera terrestre está amortiguada por las vastas áreas del océano y permanece casi constante. Por lo tanto, la absorción promedio de la radiación saliente por el agua rara vez cambia. La cantidad de CO 2 en la atmósfera no está tan bien regulada, sin embargo, y parece que las actividades humanas están provocando que se incremente. (Utilizando los datos proporcionados en el Ejemplo 4 de Ecuaciones y Relaciones de Masa, se puede calcular que aproximadamente 9.4 Pg (9.4 × 10 15 g) de CO 2 resulta de la combustión de combustibles fósiles en el mundo cada año.) Incluso en un área relativamente no industrial como Hawaii, ha habido un aumento constante en la concentración de CO 2 durante muchos años.
Refiriéndose\(\PageIndex{1}\) nuevamente a la Figura, podemos ver claramente que la absorción infrarroja por CO 2 ocurre solo en aquellas partes del espectro que no fueron bloqueadas por la absorción de H 2 O. Por lo tanto, aumentar la concentración de CO 2 debería disminuir la radiación terrestre al espacio exterior y podría aumentar la temperatura promedio de la superficie. A escala global esto se llama efecto invernadero —el CO 2 y H 2 O actúan como el vidrio en un invernadero, permitiendo que la luz visible pase pero bloqueando la pérdida de infrarrojos. Los climatólogos han pronosticado que durante los cien años que los seres humanos han estado usando combustibles fósiles, el efecto invernadero debería haber elevado las temperaturas superficiales de 0.5 a 1.0 K. Hasta 1950 esa predicción parecía haberse demostrado, pero las temperaturas medidas desde entonces han vuelto a caer hasta aproximadamente el nivel de 1900 . Los intentos de explicar esta caída sobre la base de partículas adicionales en la atmósfera han tenido diversos grados de éxito y fracaso. Todo lo que se puede decir con certeza es que sabemos mucho menos de la atmósfera y el clima mundial de lo que nos gustaría.


