21.7: Orbitales Moleculares
- Page ID
- 75244
Para explicar tanto el estado fundamental como el estado excitado involucrado en una banda de absorción en los espectros ultravioleta y visible de las moléculas, es necesario observar la estructura electrónica de las moléculas en términos algo diferentes de la descripción dada en las secciones sobre Enlace Químico y Otros Aspectos del Enlace Covalente. En esos capítulos tratamos a los electrones ya sea como pares de unión ubicados entre dos núcleos, o como pares solitarios asociados a un solo núcleo. Tal modelo de estructura electrónica se conoce como el modelo de valencia-enlace. Es de muy poca utilidad para explicar los espectros moleculares porque los fotones son absorbidos por toda la molécula, no por un átomo o enlace individual. Por lo tanto, debemos considerar los electrones en una molécula como orbitales ocupantes que pertenecen a la molécula en su conjunto. Dichos orbitales se denominan orbitales moleculares, y esta forma de observar las moléculas se conoce como teoría molecular-orbital (MO abreviada).
El término orbital molecular se menciona en la discusión de El enlace covalente cuando describimos la formación de un enlace covalente en una molécula H 2 como resultado del solapamiento de dos orbitales atómicos de 1 s, uno de cada átomo de H. En esa sección, sin embargo, no señalamos que existen dos formas en las que la onda de electrones de 1 s de un átomo de H puede combinarse con la onda de electrones de 1 s de otro. Uno de ellos implica la interferencia constructiva entre las dos ondas y se conoce como superposición positiva. Esto da como resultado una onda de electrones más grande (y por lo tanto más densidad de electrones) entre los dos núcleos atómicos. Esto atrae a los núcleos cargados positivamente juntos, formando un enlace como se describe en “El enlace covalente”. Un orbital molecular formado como resultado de la superposición positiva se llama MO de unión.
También es posible combinar dos ondas de electrones para que se produzca una interferencia destructiva de las ondas entre los núcleos atómicos. Esta situación se conoce como solapamiento negativo, y disminuye la probabilidad de encontrar un electrón entre los núcleos. En el caso de dos átomos de H esto da como resultado un nodo plano de densidad electrónica cero a medio camino entre los núcleos. Sin acumulación de carga negativa entre ellos, los núcleos se repelen entre sí y no es posible ningún enlace químico. Un orbital molecular formado como resultado del solapamiento negativo se llama MO antiunión.
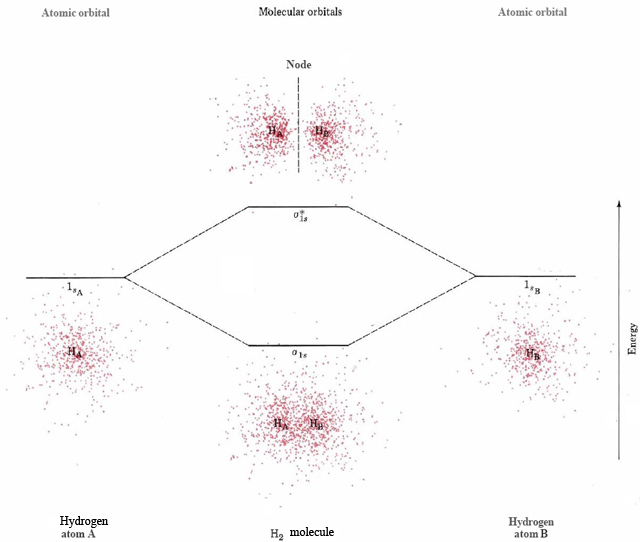
Si uno o más electrones ocupan un MO antienlace, la repulsión de los núcleos aumenta la energía de la molécula, por lo que dicho orbital es mayor en energía que un MO de unión. Esto se muestra en la Figura\(\PageIndex{1}\). Los diagramas de densidad de puntos de electrones para el electrón de 1 s en cada uno de dos átomos H separados se muestran en los lados izquierdo y derecho de la figura. Las líneas horizontales muestran la energía que tendría cada uno de estos electrones. En el centro del diagrama se muestra un diagrama de densidad de puntos para un solo electrón que ocupa el MO de unión formado por superposición positiva de los dos orbitales. Esto está etiquetado σ 1 s. Encima se encuentra un diagrama de densidad de puntos para un solo electrón que ocupa el MO antienlace, σ 1 s *. (En general, los MO antiadherentes se distinguen de los MO de unión al agregar un * a la etiqueta). Las energías de los orbitales moleculares están indicadas por las líneas horizontales en el centro del diagrama. La letra griega σ en las etiquetas de estos orbitales se refiere al hecho de que su superposición positiva o negativa ocurre directamente entre los dos núcleos atómicos. Al igual que un orbital atómico, cada orbital molecular puede acomodar dos electrones. Así, la disposición de energía más baja para H 2 colocaría ambos electrones en el MO a 1 s con espines emparejados. Esta configuración de electrones moleculares está escrita (σ 1 s) 2, y corresponde a un enlace covalente de pares de electrones que mantiene juntos los dos átomos de H. Si una muestra de H 2 es irradiada con luz ultravioleta, sin embargo, se observa una banda de absorción entre 110 y 170 nm. La energía de tal fotón absorbido es suficiente para elevar un electrón al MO antienlace, produciendo un estado excitado cuya configuración electrónica es (σ 1 s) 1 (σ 1 s *) 1. En este estado excitado los efectos del enlace y los orbitales antiunión se cancelan exactamente entre sí; no existe un enlace general entre los dos átomos de H, y la molécula H 2 se disocia. Cuando la absorción de un fotón da como resultado la disociación de una molécula como esta, el fenómeno se denomina fotodisociación. Ocurre con bastante frecuencia cuando la radiación UV golpea moléculas simples.
El modelo molecular-orbital que acabamos de describir también puede utilizarse para explicar por qué no se puede formar una molécula de He 2. Si una molécula de He 2 pudiera existir, los cuatro electrones ocuparían doblemente tanto el enlace como los orbitales antienlace, dando la configuración electrónica (σ 1 s) 2 (σ 1 s *) 2. Sin embargo, los electrones antiunión cancelarían el efecto de los electrones de unión, y no habría acumulación resultante de carga electrónica entre los núcleos y, por lo tanto, ningún enlace. Curiosamente, una extensión de este argumento predice que si He 2 pierde un electrón para convertirse en el ion He 2 +, es posible un enlace. El 2 + tendría la estructura (σ 1 s) 2 (σ 1 s *) 1 y el electrón único en el orbital antienlace solo cancelaría la mitad del efecto de los dos electrones en el orbital de unión. Esto dejaría al ion con un “medio enlace” uniendo los dos núcleos. El espectro de Él muestra bandas correspondientes a He 2 +, y a partir de ellas se puede determinar que He 2 + tiene una entalpía de enlace de 322 kJ mol —1.
El modelo molecular-orbital puede extenderse fácilmente a otras moléculas diatómicas en las que ambos átomos son idénticos (moléculas diatómicas homonucleares). Se siguen tres reglas generales. Primero, solo se deben considerar los orbitales centrales y los orbitales de valencia de los átomos. Segundo, sólo los orbitales atómicos cuyas energías son similares pueden combinarse para formar orbitales moleculares. Tercero, el número de orbitales moleculares obtenidos es siempre el mismo que el número de orbitales atómicos de los que se derivaron.
Aplicando estas reglas a moléculas diatómicas que consisten en átomos de la segunda fila de la tabla periódica, como N 2, O 2 y F 2, debemos considerar los 1 s, 2 s, 2 p x, 2 p y, y 2 p z orbitales atómicos. Dado que el orbital de 1 s de cada átomo difiere en energía de los 2s, podemos superponer los dos orbitales de 1 s por separado de los 2 s. Esto da a σ 1 s y a σ 1 s * MO, como en el caso de H 2. De igual manera, los orbitales de 2 s se pueden combinar para dar σ 2 s y σ 2 s * antes de preocuparnos por los orbitales de 2 p de mayor energía. Hay tres orbitales de 2 p en cada átomo, por lo que esperamos que se deriven de ellos un total de seis orbitales moleculares.
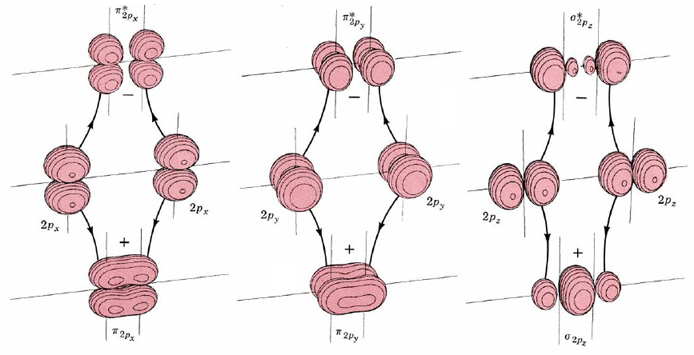
Las formas de estos seis orbitales moleculares se muestran mediante los diagramas de superficie límite en la Figura\(\PageIndex{2}\). Dos de ellos están formados por solapamiento positivo y negativo de 2 p x orbitales directamente entre los núcleos atómicos. En consecuencia se etiquetan σ 2 px y σ 2 px *. Dos orbitales moleculares más se forman por solapamiento lateral de 2 p x orbitales atómicos. Estos están etiquetados π 2 px y π 2 px *, porque los orbitales moleculares tienen dos partes, una arriba y otra debajo de un plano nodal que contiene los núcleos. Los orbitales atómicos 2 p y también se superponen lateralmente para formar orbitales moleculares π 2 py y π 2 py *. Estos son idénticos a π 2 px y π 2 px *, excepto por una rotación de 90° alrededor de la línea que conecta los núcleos. En consecuencia π 2 px y π 2 py tienen la misma energía, al igual que π 2 px * y π 2 py *.
La configuración de electrones para cualquier molécula diatómica homonuclear que contenga menos de 20 electrones se puede construir llenando electrones en los orbitales moleculares que acabamos de derivar, comenzando por el orbital de menor energía.
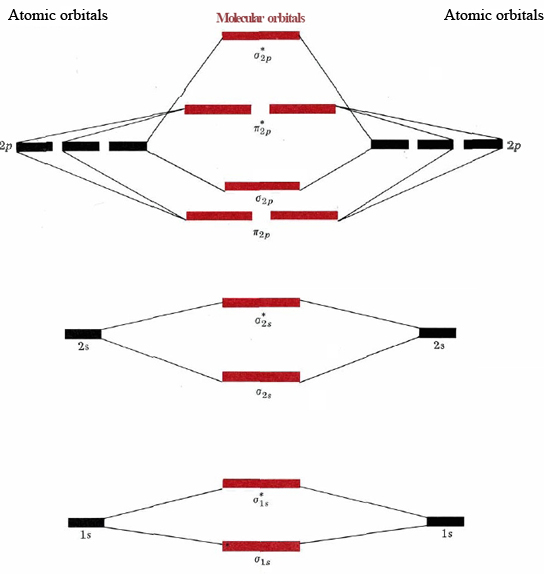
Las energías relativas de los orbitales moleculares en el momento en que se llenan se muestran en la Figura\(\PageIndex{3}\). Al igual que las energías de los orbitales atómicos dadas en la Figura 1 de las Configuraciones de Electrones, estas energías relativas molecular-orbitales varían algo de una molécula diatómica a otra. En particular, el orbital σ 2 p suele ser inferior a π 2 p. Sin embargo, la Figura\(\PageIndex{3}\) da el orden correcto de llenado de los orbitales, y podemos usarlo para determinar configuraciones de electrones moleculares.
Encuentra la configuración electrónica de la molécula de oxígeno, O 2.
Solución
Comenzando con los orbitales mentirosos más bajos (σ 1 s y σ 1 s *) agregamos un número apropiado de electrones a orbitales sucesivamente superiores de acuerdo con el principio Pauli y la regla de Hund. O 2 tiene 16 electrones, los primeros 14 de los cuales se acomodan fácilmente de la siguiente manera:
-
- \[ ( \sigma_{1s})^2 (\sigma_{1s}^* )^2 ( \sigma_{2s} )^2 (\sigma_{2s}^* )^2 ( \pi_{2p})^4 (\sigma_{2p})^2 \nonumber \]
Los dos electrones restantes deben agregarse ahora a los orbitales π 2 px *. Dado que ambos orbitales son de igual energía, se debe colocar un electrón en cada orbital y los espines deben ser paralelos. La estructura electrónica total es así
\[ (\sigma_{1s})^2 (\sigma_{1s}^*)^2 (\sigma_{2s})^2 (\sigma_{2s}^*)^2 ( \pi_{2p})^4 (\sigma_{2p})^2 (\pi_{2px}^*)^1 (\pi_{2py}^*)^1 \nonumber \]
Como muestra el problema anterior, el modelo molecular-orbital predice que O 2 tiene dos electrones desapareados. Las sustancias cuyos átomos, moléculas o iones contienen electrones desapareados son débilmente atraídas hacia un campo magnético, una propiedad conocida como paramagnetismo. (En algunos casos especiales, como el hierro, también se obsesiona una atracción magnética mucho más fuerte llamada ferromagnetismo). La mayoría de las sustancias tienen todos sus electrones emparejados. Dichos materiales son débilmente repelidos por un campo magnético, una propiedad conocida como diamagnetismo. De ahí que la medición de las propiedades magnéticas pueda decirnos si todos los electrones están emparejados o no. O 2, por ejemplo, se encuentra paramagnético, una observación que concuerda con la configuración electrónica predicha en el Ejemplo 21.6. Antes del advenimiento de la teoría MO, sin embargo, el paramagnetismo era un misterio, ya que el diagrama de Lewis predecía que todos los electrones debían ser emparejados.
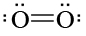
El modelo molecular-orbital también nos permite estimar las fortalezas de los enlaces en las moléculas diatómicas. Simplemente contamos cada electrón en un orbital de enlace como medio enlace que contribuye, mientras que cada electrón en un orbital antienlace quita la mitad de un enlace. Así, si hay electrones B en orbitales de unión y electrones A en orbitales antienlace, el orden de enlace neto viene dado por
\[ \text{ Bond order} = \frac{A-B}{2} \nonumber \]
Cuanto mayor es el orden de los enlaces, más fuertemente se mantienen unidos los átomos.
Calcular el orden de enlace para la molécula N 2.
Solución
Hay 14 electrones, por lo que la configuración de electrones es
\[ ( \sigma_{1s})^2 (\sigma_{1s}^* )^2 ( \sigma_{2s} )^2 (\sigma_{2s}^* )^2 ( \pi_{2p})^4 (\sigma_{2p})^2 \nonumber \]
Hay un total de 2 + 2 + 4 + 2 = 10 electrones en los MO de unión y solo 4 en los orbitales antiunión σ 1 s * y σ 2 s *. Por lo tanto
\[ \text{ Bond order} = \frac{10-4}{2} = 3 \nonumber \]
Los órdenes de enlace derivados del modelo molecular-orbital para moléculas estables concuerdan exactamente con los predichos por la teoría de Lewis. No sólo encontramos un triple enlace para N 2, sino que también encontramos un doble enlace para O 2 y un enlace sencillo para F 2. Los resultados de dichos cálculos de orden de unión se resumen en el Cuadro 1.
| Molécula* | Orden de Fianza | Enthalía de enlace/KJ mol —1 | Longitud del enlace/PM |
|---|---|---|---|
| $$\ texto {H} ^ {+} _ {2} $$ | $$\ frac {1} {2} $$ | $256$$ |
$106$$
|
| $$\ texto {H} _2$$ | $$432$$ |
$74$$
|
|
| $$\ text {Él} ^ {+} _ {2} $$ | $$\ frac {1} {2} $$ | $$322$$ |
$108$$
|
| $$\ text {Él} _2$$ |
|
|
|
| $$\ text {Li} _2$$ |
|
$$110$$ |
$267$$
|
| $$\ text {Be} _2$$ |
|
|
|
| $$\ texto {B} _2$$ |
|
$274$$ |
$$159$$
|
| $$\ texto {C} _2$$ |
|
$603$$ |
$$124$$
|
| $$\ texto {N} _2$$ |
|
$$942$$ |
$$110$$
|
| $$\ texto {O} _2$$ |
|
$494$$ |
$$121$$
|
| $$\ texto {F} _2$$ |
|
$$139$$ |
$$142$$
|
| $$\ text {Ne} _2$$ |
|
|
|
* Se incluyen algunos iones moleculares como H 2 +. Excepto por el número de electrones involucrados, la teoría MO se les aplica exactamente de la misma manera que a las moléculas.
Algunas de las moléculas de la tabla, como C 2 y B 2, solo son estables a altas temperaturas o solo existen transitoriamente en tubos de descarga, por lo que probablemente no esté familiarizado con ellas. Sin embargo, sus espectros pueden ser estudiados. También se incluyen en la tabla valores para las entalpías de enlace y longitudes de enlace de las diversas especies obtenidas de sus espectros. Obsérvese el excelente acuerdo cualitativo con la teoría MO. Cuanto mayor sea el orden de enlace predicho por la teoría, mayor será la entalpía del enlace y menor será la longitud del enlace.


