22.1: Preludio a los Metales
- Page ID
- 76131
Aproximadamente tres cuartas partes de los elementos conocidos muestran las propiedades macroscópicas características de los metales. Conducen muy bien tanto el calor como la electricidad; tienen superficies brillantes; son capaces de ser moldeadas por martilleo (maleables) y también de ser arrastradas en alambres (dúctiles). Estas propiedades se pueden entender en términos de unión metálica en la que los electrones de valencia se deslocalizan sobre un cristal metálico completo. Los iones metálicos positivos formados por la pérdida de electrones de valencia se mantienen unidos por un mar de electrones. La fuerza de la unión metálica varía aproximadamente según el número de electrones disponibles en este mar. Las propiedades químicas de los metales incluyen una tendencia a perder electrones y formar iones positivos, y la capacidad de sus óxidos para funcionar como bases. La extensión de estas características varía de un metal a otro. Varios casos límite como B, Si, Ge, As, Sb y Te son difíciles de clasificar como metales o no metales. Estos elementos suelen ser referidos como los metaloides o semimetales. Como recordará de la discusión sobre los metales en la tabla periódica, se puede trazar una línea en zigzag a través de la tabla periódica de B a At que separa los metales de los no metales y semimetales. Esta línea está claramente indicada en la mayoría de las tablas periódicas. Tabla Periódica en Vivo permite seleccionar metales, semimetales o no metales y ver cómo se dividen en la tabla periódica.
Una gran cantidad de metales y aleaciones son de importancia comercial, pero los metales se encuentran naturalmente en minerales de óxido, carbonato o sulfuro. Dichos minerales deben concentrarse (beneficiarse) antes de que puedan reducirse al metal, y generalmente el metal en bruto debe purificarse (refinarse) en un tercer paso. Un excelente ejemplo de estos procesos involucra el hierro que puede ser fácilmente beneficiado porque su mineral es ferromagnético. Luego se reduce el mineral de hierro en un alto horno y se purifica en un horno de fabricación de acero. Dado que la reducción de mineral es un proceso no espontáneo, su inversión, oxidación o corrosión de un metal, suele ser un problema. Esto es especialmente cierto en el caso del hierro porque el recubrimiento de óxido que se forma en la superficie metálica no protege al metal restante de la oxidación atmosférica.
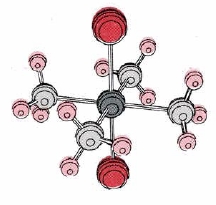
Aquí nos ocuparemos principalmente de los metales de transición. Ya hemos cubierto metales que son elementos representativos, como los metales alcalinos y los metales alcalinotérreos. Una discusión sobre los metales lantanoides y actinoides está fuera del alcance de la química general. Dado que los metales de transición contienen d electrones en su capa de valencia, su química es algo diferente de la de los elementos representativos. En particular forman una familia de compuestos llamados compuestos complejos o compuestos de coordinación que son muy diferentes a los que hemos encontrado hasta este momento. En estos complejos, varios ligandos que pueden servir como bases de Lewis están unidos a un ion metálico que sirve como un ácido de Lewis. El número de ligandos se denomina número de coordinación, y define las posibles geometrías de un complejo. Para un número de coordinación de 2 el complejo suele ser lineal. Tanto las estructuras planas cuadradas como las tetraédricas ocurren para la coordinación número 4, y la coordinación, número 6 generalmente involucra una estructura octaédrica. Las estructuras planas cuadradas y octaédricas dan lugar a isomería cis-trans.
Algunos ligandos, llamados agentes quelantes, pueden coordinar-enlace covalente a iones metálicos en más de un sitio. Los complejos de quelatos suelen ser importantes en los sistemas biológicos porque pueden disfrazar la carga de un ion metálico, estabilizando el ion en un ambiente hidrófobo.
En solución acuosa, los iones metálicos de transición suelen estar coordinados octaédricamente por moléculas de agua, pero a menudo otros ligandos que son bases de Lewis más fuertes reemplazan al agua. Tales reacciones suelen producir cambios de color, y suelen ser rápidas. Algunos iones metálicos, como Cr (III), Co (III), Pt (IV) y Pt (II), experimentan la sustitución del ligando con bastante lentitud y se dice que son inertes. Se dice que los iones metálicos cuyas reacciones son rápidas son lábiles.


