22.2: Adhesión Metálica
- Page ID
- 76142
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La mayoría de los metales tienen estructuras cristalinas muy compactas que involucran las celosías cúbicas centradas en el cuerpo, cúbicas centradas en la cara o hexagonales Así, cada átomo en un metal suele estar rodeado por 8 o 12 vecinos equivalentes más cercanos. ¿Cómo se puede unir cada átomo a tantos de sus compañeros átomos? Si bien hay muchos átomos electropositivos para donar electrones, no hay átomos electronegativos para recibirlos, por lo que la unión iónica parece poco probable. También se puede descartar el enlace covalente ordinario. Cada enlace covalente requeriría un electrón de cada átomo, y ningún metal tiene 12 electrones de valencia.
Una pista valiosa sobre la naturaleza de la unión en los metales es proporcionada por su capacidad para conducir electricidad. Los electrones pueden alimentarse en un extremo de un cable metálico y eliminarse del otro extremo sin causar ningún cambio obvio en las propiedades físicas y químicas del metal. Para dar cuenta de esta libertad de movimiento, las teorías modernas del enlace metálico asumen que los electrones de valencia están completamente deslocalizados; es decir, ocupan orbitales moleculares pertenecientes al cristal metálico en su conjunto. Estos electrones deslocalizados a menudo se conocen como un gas de electrones o un mar de electrones. Los iones metálicos positivos producidos por la pérdida de estos electrones de valencia pueden considerarse entonces como “flotantes” en este mar tridimensional. Cada ion se mantiene en su lugar por la atracción del mar de electrones cargado negativamente y la repulsión de sus compañeros iones positivos.
Para ver cómo se puede aplicar la teoría MO a los metales, consideremos primero el caso más simple, el litio. Si se juntan dos átomos de litio, los electrones centrales de 1 s permanecen esencialmente sin cambios ya que prácticamente no hay superposición entre ellos. Los orbitales 2s, por el contrario, se superponen extensamente y producen tanto una orbital de unión como una orbital antiadhesión. Solo el orbital de unión estará realmente ocupado por los dos electrones, como se muestra en la Figura 1. Algo más altos que estos dos orbitales son un grupo de seis orbitales desocupados producidos por la superposición de seis orbitales atómicos de 2 p (tres en cada átomo). Supongamos ahora agregamos un tercer átomo a los dos ya considerados para que formemos una molécula triangular de fórmula Li 3. Como se muestra en la figura, el solapamiento de tres orbitales de 2 s produce un grupo inferior de tres orbitales, mientras que el solapamiento de tres por tres orbitales de 2 p produce un grupo superior de nueve orbitales. Nuevamente el número total de orbitales moleculares es igual al número de orbitales atómicos de los que se derivan.
Continuando agregando átomos de litio de esta manera, pronto alcanzamos un cúmulo de 25 átomos de litio. La situación de nivel de energía para un cúmulo de este tamaño es un grupo inferior de 25 MO, todos derivados de orbitales atómicos de 2 s, y un grupo superior de 75 MO, todos derivados de orbitales atómicos de 2 p. Observe cuán estrechamente espaciados se han vuelto estos niveles de energía. Esto está en línea con la tendencia de que los niveles de energía se acerquen cuanto mayor sea el grado de deslocalización.
Por último, si agregamos suficientes átomos de litio a nuestro cúmulo para hacer una muestra visible y pesable de litio, digamos 10 20 átomos, el espaciamiento de energía entre los orbitales moleculares se vuelve tan pequeño que es imposible indicarlo en la figura o incluso medir. En efecto, un salto de electrones entre estos niveles puede tener cualquier energía dentro de una banda ancha de menor a mayor. En consecuencia, esta visión de la estructura electrónica en sólidos a menudo se conoce como la teoría de bandas de sólidos.
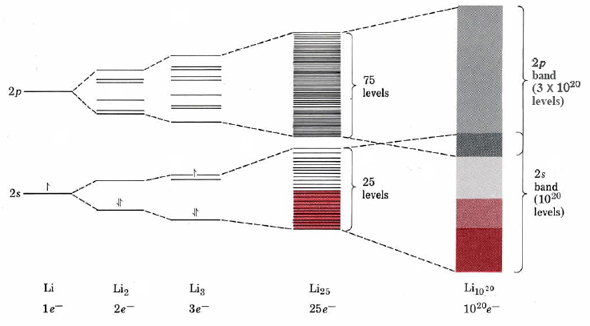
También debe quedar claro a partir de Figura\(\PageIndex{1}\) que no es necesario que todos los orbitales moleculares disponibles estén completamente llenos de electrones. En el caso del litio, por ejemplo, una muestra que contiene 10 20 átomos tendría 10 20 electrones de valencia. Dado que cada átomo tendría un solo orbital de 2 s así como tres orbitales de 2 p, habría 1 × 10 20 MO en la banda de 2 s y 3 × 10 20 MO en la banda de 2 p. Si todos los electrones estuvieran emparejados, solo se requerirían los 0.5 × 10 20 MO de menor energía en la banda de 2 s para mantenerlos. Tenga en cuenta que existe una buena correspondencia entre la banda medio llena de 2 s de la muestra macroscópica y el orbital medio lleno de 2 s de un átomo de Li individual.
Según la teoría de bandas, es este relleno parcial el que explica la alta conductancia eléctrica y térmica de los metales. Si se aplica un campo eléctrico a un conductor metálico, algunos electrones pueden ser forzados a entrar en un extremo, ocupando niveles de energía ligeramente superiores a los que ya están ahí. Como consecuencia de la deslocalización, esta mayor energía electrónica está disponible en todo el metal. Por lo tanto, puede resultar en un flujo casi instantáneo de electrones desde el otro extremo del conductor.
Un argumento similar se aplica a la transferencia de energía térmica. Calentar una pequeña región en un sólido equivale a aumentar la energía de movimiento de los núcleos atómicos y electrones en esa región. Dado que los núcleos ocupan posiciones específicas de celosía, la conducción de calor requiere que la energía se transfiera entre los vecinos más cercanos. Así, cuando se calienta el borde de un sólido, los átomos en esa región vibran más extensamente alrededor de sus posiciones promedio de la red.
También inducen a sus vecinos a vibrar, eventualmente transfiriendo calor al interior de la muestra. Este proceso puede acelerarse enormemente si parte de la energía agregada eleva los electrones a MO de mayor energía dentro de una banda incompletamente llena. La deslocalización de electrones permite una rápida transferencia de esta energía a otros núcleos atómicos, algunos de los cuales pueden estar bastante lejos de la fuente original.
Cuando una banda de energía está completamente llena de electrones, el mecanismo que se acaba de describir para la conducción eléctrica y térmica ya no puede funcionar. En tal caso obtenemos un sólido que es un conductor de electricidad muy pobre, o un aislante. A primera vista podríamos esperar que Be, Mg y otras tierras alcalinas sean aislantes como este. Dado que todos los átomos de estos elementos contienen subconchas rellenas de 2 s, anticiparíamos una banda llena de 2 s en el sólido para todos ellos. Que este no sea el caso se debe a la diferencia de energía relativamente pequeña entre los niveles de 2 s y 2 p en estos átomos. Como puede ver en la Figura\(\PageIndex{1}\), esta pequeña separación da como resultado un solapamiento entre las bandas de 2 s y 2 p. Así, los electrones pueden moverse fácilmente de una banda a la otra y proporcionar un mecanismo para la conducción.
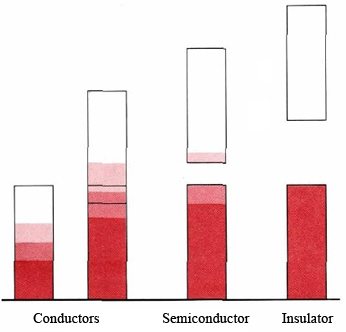
La figura\(\PageIndex{2}\) muestra cuatro posibilidades diferentes para la estructura de bandas en un sólido. Para que un sólido sea conductor, una banda debe estar parcialmente llena o debe superponerse a una banda más alta sin llenar. Cuando hay una brecha de energía muy grande entre las bandas y se llena la banda inferior, tenemos un aislante. Si la brecha es bastante pequeña, obtenemos una situación intermedia y el sólido es un semiconductor. Todos los semimetales que se encuentran a lo largo de la escalera diagonal en la tabla periódica, notablemente el germanio, tienen una estructura de bandas de este tipo.
En un semiconductor encontramos que las colisiones entre átomos y electrones en el cristal son ocasionalmente lo suficientemente energéticas como para excitar un electrón hacia la banda superior. Como resultado siempre hay un pequeño número de electrones en esta banda y un número igual de agujeros (orbitales de los que se han eliminado electrones) en la banda de menor energía. Los electrones excitados pueden llevar corriente eléctrica porque muchos niveles de energía diferentes están disponibles para ellos. También pueden los agujeros, otros electrones de la banda casi llena pueden moverse hacia arriba o hacia abajo en ellos, un proceso que disminuye o aumenta la energía del agujero.
En un metal, la conductividad eléctrica disminuye a medida que se eleva la temperatura debido a que los núcleos vibran más lejos de sus posiciones de reposo y por lo tanto se interponen en el camino de mover los electrones de valencia con mayor frecuencia. Exactamente el comportamiento opuesto se encuentra para los semiconductores. Al aumentar la temperatura, cada vez más electrones se excitan a la banda de conducción de mayor energía para que se pueda transportar más corriente. La excitación de los electrones a la banda de conducción también se puede lograr mediante un fotón, un fenómeno conocido como fotoconducción. El metal selenio se suele utilizar de esta manera como fotocélula en medidores de luz y “ojos eléctricos”.
El modelo electrón-mar de los metales no solo explica sus propiedades eléctricas sino también su maleabilidad y ductilidad. Cuando una capa de iones en un mar de electrones se mueve a lo largo de un espacio con respecto a la capa debajo de él, un proceso que podemos representar pictóricamente como:
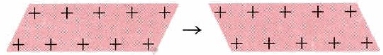
La situación final es muy parecida a la inicial. Así, si golpeamos un metal con un martillo, los cristales no se rompen, sino que simplemente cambian su forma, Esto es muy diferente al comportamiento de los cristales iónicos.
El modelo electrón-mar también nos permite explicar, al menos parcialmente, por qué el enlace metálico es notablemente más fuerte para algunos metales que para otros. Si bien los metales alcalinos y algunos de los metales alcalinotérreos se pueden cortar con un cuchillo, los metales como el tungsteno son lo suficientemente duros como para rayar el cuchillo en sí. Una buena indicación de cómo varía la resistencia de la unión metálica con la posición en la tabla periódica viene dada por el punto de fusión.
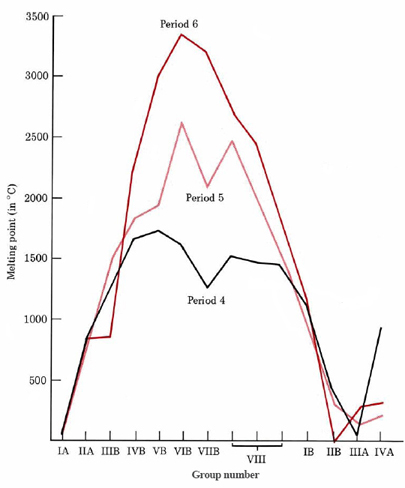
Como puede verse en la Figura\(\PageIndex{3}\), si el punto de fusión de los metales se grafica contra el número de grupo por los tres largos periodos, se produce un fuerte incremento del grupo IA al grupo VB o VIB, después de lo cual se produce una nivelación. Finalmente el punto de fusión vuelve a caer a valores bastante bajos. Se encuentra un comportamiento similar para otras propiedades como el punto de ebullición, entalpía de fusión, densidad y dureza.
Los incrementos iniciales en la fuerza de la unión metálica a medida que pasamos del grupo IA al VIB pueden explicarse en términos del número de electrones de valencia que el metal es capaz de aportar al mar de electrones. Cuantos más electrones pierda un átomo, mayor será la carga del ion positivo embebido en el mar de electrones y mayor será la densidad de probabilidad de electrones del propio mar de electrones. Así, cuantos más electrones se pierdan, más estrechamente se mantendrán unidos los iones. El cromo con seis electrones de valencia es así mucho más duro que el sodio con uno.
Sin embargo, esta tendencia no puede continuar indefinidamente. Cuantos más electrones se eliminen de un átomo, más energía se necesita para eliminar el siguiente electrón. Eventualmente encontramos que se necesita más energía para eliminar un electrón de un núcleo metálico que la que se libera colocándolo en el mar de electrones. La fuerza de la unión así comienza a nivelarse y eventualmente a caer. Cabe señalar que la fuerza de unión metálica no depende únicamente del número de electrones de valencia (o del número de grupo periódico) de un elemento. Otros factores como el radio atómico y el tipo de celosía cristalina también son importantes. Sin embargo, es útil recordar que los puntos de fusión y otras propiedades relacionadas con la fuerza de unión metálica alcanzan su máximo aproximadamente a la mitad de cada serie de transición.


