2.1: Las primeras ideas en la teoría atómica
- Page ID
- 77614
Habilidades para Desarrollar
Al final de esta sección, podrás:
- Exponer los postulados de la teoría atómica de Dalton
- Utilizar postulados de la teoría atómica de Dalton para explicar las leyes de proporciones definidas y múltiples
El lenguaje utilizado en la química es visto y escuchado en muchas disciplinas, que van desde la medicina hasta la ingeniería, pasando por la forense y el arte. El lenguaje de la química incluye su propio vocabulario así como su propia forma de taquigrafía. Los símbolos químicos se utilizan para representar átomos y elementos. Las fórmulas químicas representan moléculas así como la composición de los compuestos. Las ecuaciones químicas proporcionan información sobre la calidad y cantidad de los cambios asociados con las reacciones químicas.
Este capítulo sentará las bases para nuestro estudio del lenguaje de la química. Los conceptos de esta base incluyen la teoría atómica, la composición y masa de un átomo, la variabilidad de la composición de los isótopos, la formación de iones, los enlaces químicos en compuestos iónicos y covalentes, los tipos de reacciones químicas y la denominación de los compuestos. También presentaremos una de las herramientas más poderosas para organizar el conocimiento químico: la tabla periódica.
Teoría atómica a través del siglo XIX
La discusión más temprana registrada sobre la estructura básica de la materia proviene de los filósofos griegos antiguos, los científicos de su época. En el siglo V a.C., Leucipo y Demócrito argumentaron que toda la materia estaba compuesta por partículas pequeñas y finitas que llamaban atomos, término derivado de la palabra griega para “indivisible”. Pensaban en los átomos como partículas móviles que diferían en forma y tamaño, y que podían unirse. Posteriormente, Aristóteles y otros llegaron a la conclusión de que la materia consistía en varias combinaciones de los cuatro “elementos” —fuego, tierra, aire y agua— y podía dividirse infinitamente. Curiosamente, estos filósofos pensaron en los átomos y los “elementos” como conceptos filosóficos, pero aparentemente nunca consideraron realizar experimentos para poner a prueba sus ideas.
La visión aristotélica de la composición de la materia dominó durante más de dos mil años, hasta que el profesor de inglés John Dalton ayudó a revolucionar la química con su hipótesis de que el comportamiento de la materia podría explicarse utilizando una teoría atómica. Publicado por primera vez en 1807, muchas de las hipótesis de Dalton sobre las características microscópicas de la materia siguen siendo válidas en la teoría atómica moderna. Aquí están los postulados de la teoría atómica de Dalton.
- La materia está compuesta por partículas sumamente pequeñas llamadas átomos. Un átomo es la unidad más pequeña de un elemento que puede participar en un cambio químico.
- Un elemento consiste en un solo tipo de átomo, que tiene una masa que es característica del elemento y es la misma para todos los átomos de ese elemento (Figura\(\PageIndex{1}\)). Una muestra macroscópica de un elemento contiene un número increíblemente grande de átomos, todos los cuales tienen propiedades químicas idénticas.

- Los átomos de un elemento difieren en propiedades de los átomos de todos los demás elementos.
- Un compuesto consiste en átomos de dos o más elementos combinados en una pequeña relación de número entero. En un compuesto dado, los números de átomos de cada uno de sus elementos están siempre presentes en la misma proporción (Figura\(\PageIndex{2}\)).

- Los átomos no se crean ni se destruyen durante un cambio químico, sino que se reordenan para producir sustancias que son diferentes a las presentes antes del cambio (Figura\(\PageIndex{3}\)).
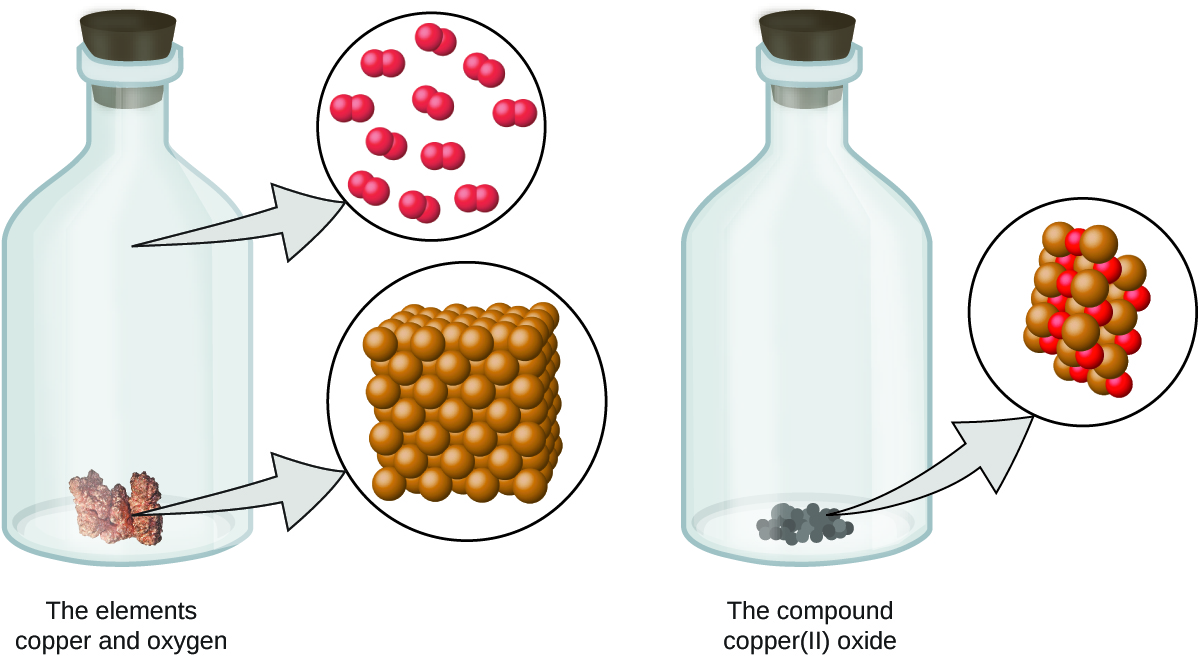
La teoría atómica de Dalton proporciona una explicación microscópica de las muchas propiedades macroscópicas de la materia que has aprendido. Por ejemplo, si un elemento como el cobre consiste en un solo tipo de átomo, entonces no se puede descomponer en sustancias más simples, es decir, en sustancias compuestas por menos tipos de átomos. Y si los átomos no son creados ni destruidos durante un cambio químico, entonces la masa total de materia presente cuando la materia cambia de un tipo a otro permanecerá constante (la ley de conservación de la materia).
Ejemplo\(\PageIndex{1}\): Prueba de la teoría atómica de Dalton
En el siguiente dibujo, las esferas verdes representan átomos de cierto elemento. Las esferas moradas representan átomos de otro elemento. Si las esferas se tocan, forman parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? Si es así, ¿cuál?
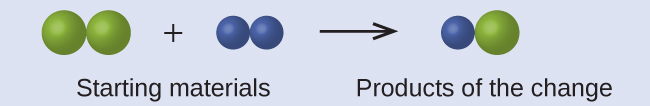
Solución Los materiales de partida consisten en dos esferas verdes y dos esferas moradas. Los productos constan de una sola esfera verde y una esfera morada. Esto viola el postulado de Dalton de que los átomos no se crean ni se destruyen durante un cambio químico, sino que simplemente se redistribuyen. (En este caso, los átomos parecen haber sido destruidos).
Ejercicio\(\PageIndex{1}\)
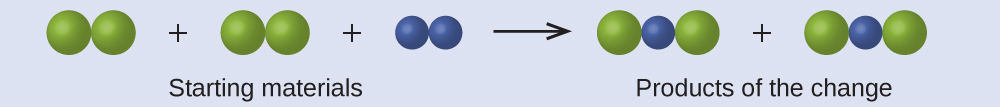
En el siguiente dibujo, las esferas verdes representan átomos de cierto elemento. Las esferas moradas representan átomos de otro elemento. Si las esferas se tocan, forman parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? Si es así, cuál
Respuesta:
Los materiales de partida constan de cuatro esferas verdes y dos esferas moradas. Los productos constan de cuatro esferas verdes y dos esferas moradas. Esto no viola ninguno de los postulados de Dalton: Los átomos no se crean ni destruyen, sino que se redistribuyen en pequeñas proporciones de números enteros.
Dalton conocía los experimentos del químico francés Joseph Proust, quien demostró que todas las muestras de un compuesto puro contienen los mismos elementos en la misma proporción en masa. A esta afirmación se le conoce como la ley de proporciones definidas o la ley de la composición constante. La sugerencia de que los números de átomos de los elementos en un compuesto dado siempre existen en la misma proporción es consistente con estas observaciones. Por ejemplo, cuando se analizan diferentes muestras de isooctano (un componente de la gasolina y uno de los estándares utilizados en el sistema de clasificación de octano), se encuentra que tienen una relación másica carbono-hidrógeno de 5. 33:1, como se muestra en la Tabla\(\PageIndex{1}\).
| Muestra | Carbono | Hidrógeno | Relación Masa |
|---|---|---|---|
| A | 14.82 g | 2.78 g | \(\mathrm{\dfrac{14.82\: g\: carbon}{2.78\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| B | 22.33 g | 4.19 g | \(\mathrm{\dfrac{22.33\: g\: carbon}{4.19\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| C | 19.40 g | 3.64 g | \(\mathrm{\dfrac{19.40\: g\: carbon}{3.63\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
Cabe señalar que aunque todas las muestras de un compuesto en particular tienen la misma relación de masa, lo contrario no es cierto en general. Es decir, las muestras que tienen la misma relación de masa no son necesariamente la misma sustancia. Por ejemplo, existen muchos compuestos distintos al isooctano que también tienen una relación másica carbono-hidrógeno de 5. 33:1 .00.
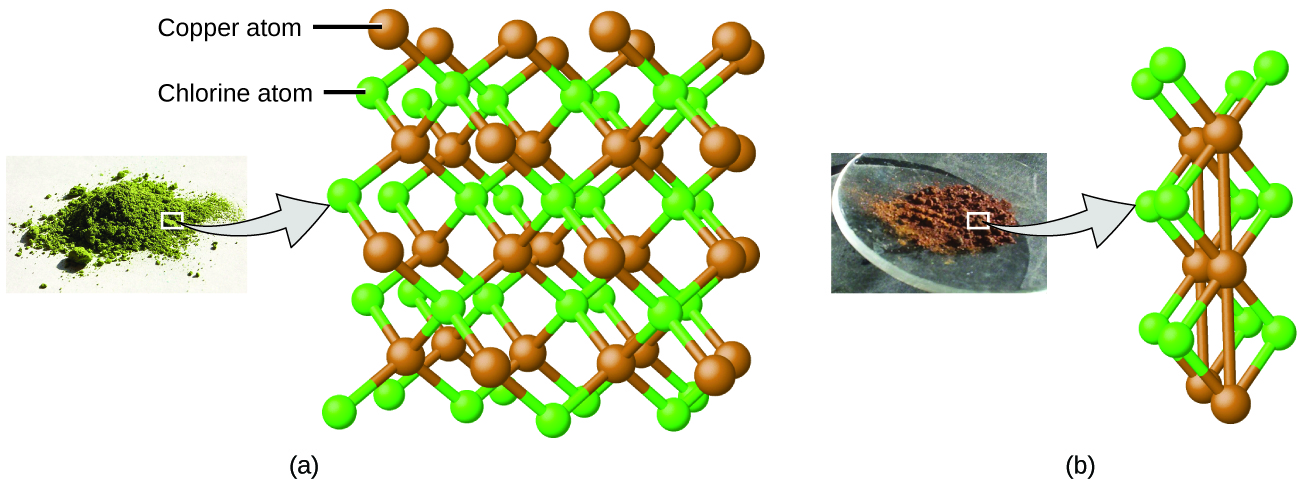
Dalton también utilizó datos de Proust, así como resultados de sus propios experimentos, para formular otra ley interesante. La ley de proporciones múltiples establece que cuando dos elementos reaccionan para formar más de un compuesto, una masa fija de un elemento reaccionará con las masas del otro elemento en una proporción de números pequeños, enteros. Por ejemplo, el cobre y el cloro pueden formar un sólido cristalino verde con una relación en masa de 0.558 g de cloro a 1 g de cobre, así como un sólido cristalino marrón con una relación en masa de 1.116 g de cloro a 1 g de cobre. Estas proporciones por sí mismas pueden no parecer particularmente interesantes o informativas; sin embargo, si tomamos una relación de estas proporciones, obtenemos un resultado útil y posiblemente sorprendente: una pequeña relación de números enteros.
\[\mathrm{\dfrac{\dfrac{1.116\: g\: Cl}{1\: g\: Cu}}{\dfrac{0.558\: g\: Cl}{1\: g\: Cu}}=\dfrac{2}{1}}\]
Esta relación 2 a 1 significa que el compuesto marrón tiene el doble de la cantidad de cloro por cantidad de cobre que el compuesto verde.
Esto puede explicarse por la teoría atómica si la relación cobre-cloro en el compuesto marrón es de 1 átomo de cobre a 2 átomos de cloro, y la relación en el compuesto verde es de 1 átomo de cobre por 1 átomo de cloro. La relación de átomos de cloro (y por lo tanto la relación de sus masas) es, por lo tanto, de 2 a 1 (Figura\(\PageIndex{4}\)).
Ejemplo \(\PageIndex{2}\): Leyes de proporciones definidas y múltiples
Se analiza una muestra del compuesto A (un gas transparente e incoloro) y se encuentra que contiene 4.27 g de carbono y 5.69 g de oxígeno. Se analiza una muestra del compuesto B (también un gas transparente e incoloro) y se encuentra que contiene 5.19 g de carbono y 13.84 g de oxígeno. ¿Son estos datos un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna de las dos? ¿Qué le dicen estos datos sobre las sustancias A y B?
Solución
En el compuesto A, la relación másica de carbono a oxígeno es:
\[\mathrm{\dfrac{1.33\: g\: O}{1\: g\: C}}\]
En el compuesto B, la relación másica de carbono a oxígeno es:
\[\mathrm{\dfrac{2.67\: g\: O}{1\: g\: C}}\]
La relación de estas proporciones es:
\[\mathrm{\dfrac{\dfrac{1.33\: g\: O}{1\: g\: C}}{\dfrac{2.67\: g\: O}{1\: g\: C}}=\dfrac{1}{2}}\]
Esto apoya la ley de múltiples proporciones. Esto significa que A y B son compuestos diferentes, teniendo A la mitad de carbono por cantidad de oxígeno (o el doble de oxígeno por cantidad de carbono) que B. Un posible par de compuestos que se ajustarían a esta relación sería A = CO 2 y B = CO.
Ejercicio\(\PageIndex{2}\)
Se analiza una muestra del compuesto X (un líquido combustible transparente, incoloro, con un olor notable) y se encuentra que contiene 14.13 g de carbono y 2.96 g de hidrógeno. Se analiza una muestra del compuesto Y (un líquido combustible transparente, incoloro, con un olor notable que es ligeramente diferente del olor de X) y se encuentra que contiene 19.91 g de carbono y 3.34 g de hidrógeno. ¿Son estos datos un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna de las dos? ¿Qué le dicen estos datos sobre las sustancias X e Y?
Respuesta:
En el compuesto X, la relación másica de carbono a hidrógeno es\(\mathrm{\dfrac{14.13\: g\: C}{2.96\: g\: H}}\). En el compuesto Y, la relación másica de carbono a oxígeno es\(\mathrm{\dfrac{19.91\: g\: C}{3.34\: g\: H}}\). La relación de estas proporciones es\(\mathrm{\dfrac{\dfrac{14.13\: g\: C}{2.96\: g\: H}}{\dfrac{19.91\: g\: C}{3.34\: g\: H}}=\dfrac{4.77\: g\: C/g\: H}{5.96\: g\: C/g\: H}=0.800=\dfrac{4}{5}}\). Esta pequeña proporción de números enteros apoya la ley de proporciones múltiples. Esto significa que X e Y son compuestos diferentes.
Resumen
Los antiguos griegos propusieron que la materia consiste en partículas extremadamente pequeñas llamadas átomos. Dalton postuló que cada elemento tiene un tipo característico de átomo que difiere en propiedades de los átomos de todos los demás elementos, y que los átomos de diferentes elementos pueden combinarse en proporciones fijas, pequeñas, de número entero para formar compuestos. Todas las muestras de un compuesto en particular tienen las mismas proporciones elementales en masa. Cuando dos elementos forman compuestos diferentes, una masa dada de un elemento se combinará con las masas del otro elemento en una pequeña relación de número entero. Durante cualquier cambio químico, los átomos no son creados ni destruidos.
Glossary
- Dalton’s atomic theory
- set of postulates that established the fundamental properties of atoms
- law of constant composition
- (also, law of definite proportions) all samples of a pure compound contain the same elements in the same proportions by mass
- law of definite proportions
- (also, law of constant composition) all samples of a pure compound contain the same elements in the same proportions by mass
- law of multiple proportions
- when two elements react to form more than one compound, a fixed mass of one element will react with masses of the other element in a ratio of small whole numbers
Contributors
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).


