2.2: Evolución de la Teoría Atómica
- Page ID
- 77605
- Esbozar hitos en el desarrollo de la teoría atómica moderna
- Resumir e interpretar los resultados de los experimentos de Thomson, Millikan y Rutherford
- Describir las tres partículas subatómicas que componen los átomos
- Introducir el término isótopos
En los dos siglos transcurridos desde que Dalton desarrolló sus ideas, los científicos han logrado avances significativos en la promoción de nuestra comprensión de la teoría atómica. Gran parte de esto provino de los resultados de varios experimentos seminales que revelaron los detalles de la estructura interna de los átomos. Aquí, discutiremos algunos de esos desarrollos clave, con énfasis en la aplicación del método científico, así como entendiendo cómo se analizó la evidencia experimental. Si bien las personas históricas y las fechas detrás de estos experimentos pueden ser bastante interesantes, lo más importante es comprender los conceptos resultantes de su trabajo.
Teoría atómica después del siglo XIX
Si la materia estuviera compuesta por átomos, ¿de qué estaban compuestos los átomos? ¿Eran las partículas más pequeñas, o había algo más pequeño? A finales del siglo XIX, varios científicos interesados en preguntas como estas investigaron las descargas eléctricas que podrían producirse en los gases de baja presión, con el descubrimiento más significativo realizado por el físico inglés J. J. Thomson usando un tubo de rayos catódicos. Este aparato consistía en un tubo de vidrio sellado del que se había retirado casi todo el aire; el tubo contenía dos electrodos metálicos. Cuando se aplicó alto voltaje a través de los electrodos, apareció entre ellos un haz visible llamado rayo catódico. Este haz se desvió hacia la carga positiva y lejos de la carga negativa, y se produjo de la misma manera con propiedades idénticas cuando se utilizaron diferentes metales para los electrodos. En experimentos similares, el rayo fue desviado simultáneamente por un campo magnético aplicado, y las mediciones de la extensión de la deflexión y la intensidad del campo magnético permitieron a Thomson calcular la relación carga-masa de las partículas de rayos catódicos. Los resultados de estas mediciones indicaron que estas partículas eran mucho más ligeras que los átomos (Figura\(\PageIndex{1}\)).
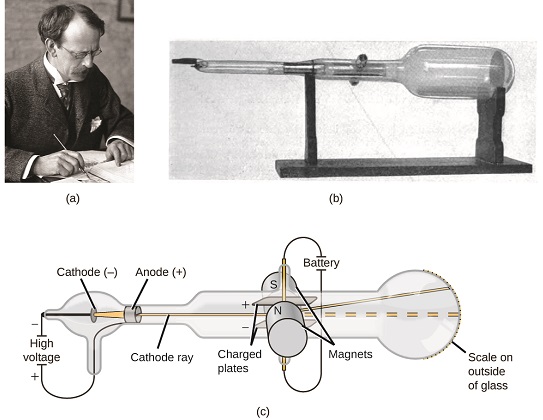
Con base en sus observaciones, aquí está lo que Thomson propuso y por qué: Las partículas son atraídas por cargas positivas (+) y repelidas por cargas negativas (−), por lo que deben estar cargadas negativamente (como las cargas repelen y a diferencia de las cargas atraen); son menos masivas que los átomos e indistinguibles, independientemente de la material fuente, por lo que deben ser constituyentes fundamentales, subatómicos de todos los átomos. Aunque polémica en su momento, la idea de Thomson fue poco a poco aceptada, y su partícula de rayos catódicos es lo que ahora llamamos un electrón, una partícula subatómica cargada negativamente con una masa más de mil veces menor que la de un átomo. El término “electrón” fue acuñado en 1891 por el físico irlandés George Stoney, a partir de “electr ic i on”.
En 1909, más información sobre el electrón fue descubierta por el físico estadounidense Robert A. Millikan a través de sus experimentos de “gotas de petróleo”. Millikan creó gotitas microscópicas de aceite, que podrían cargarse eléctricamente por fricción a medida que se formaban o mediante el uso de rayos X. Estas gotitas cayeron inicialmente debido a la gravedad, pero su avance hacia abajo podría ser ralentizado o incluso revertido por un campo eléctrico más bajo en el aparato. Al ajustar la intensidad del campo eléctrico y realizar mediciones cuidadosas y cálculos apropiados, Millikan pudo determinar la carga en gotas individuales (Figura\(\PageIndex{2}\)).
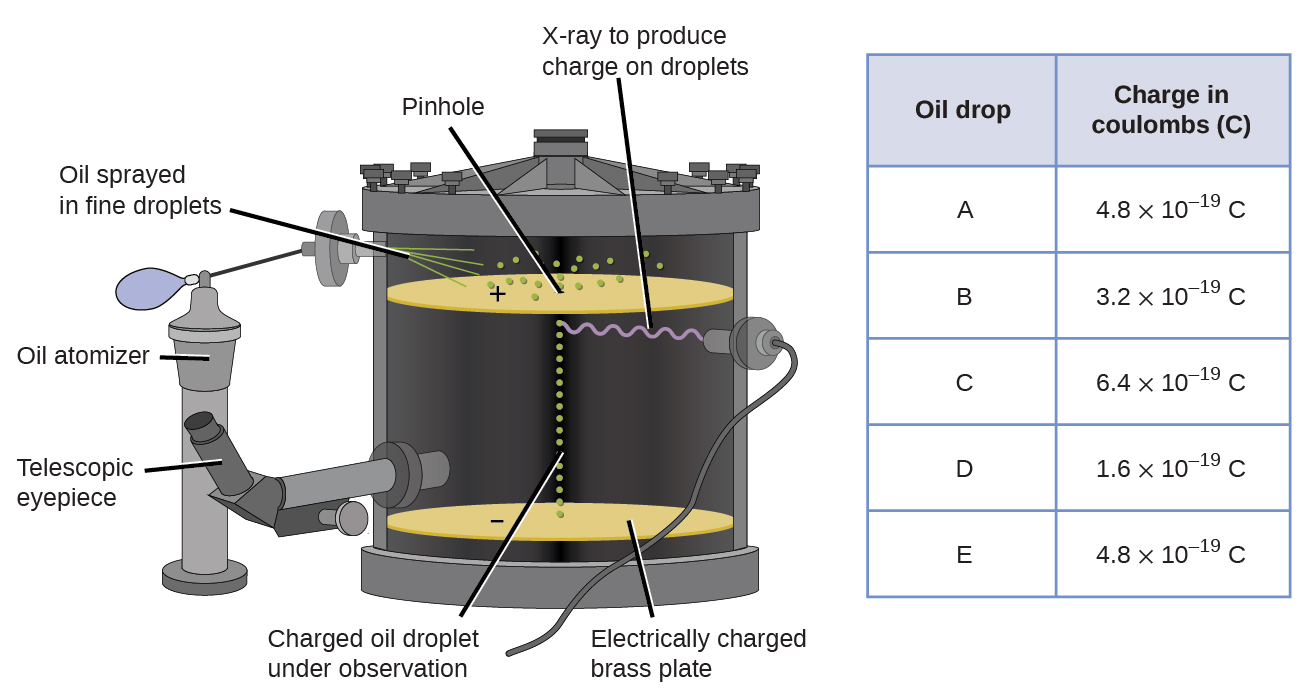
Al observar los datos de carga que Millikan recopiló, es posible que haya reconocido que la carga de una gotita de aceite siempre es un múltiplo de una carga específica, 1.6\(\times\) 10 −19 C. Millikan concluyó que este valor debe ser, por lo tanto, una carga fundamental, la carga de un solo electrón, con su medida carga debido a un exceso de un electrón (1 por 1.6\(\times\) 10 −19 C), dos electrones (2 veces 1.6\(\times\) 10 −19 C), tres electrones (3 veces 1.6\(\times\) 10 −19 C), y así sucesivamente, en una gotita de aceite dada. Dado que la carga de un electrón ahora se conocía debido a la investigación de Millikan, y la relación carga-masa ya se conocía debido a la investigación de Thomson (1.759\(\times\) 10 11 C/kg), solo requirió un cálculo simple para determinar la masa del electrón también.
\[\mathrm{Mass\: of\: electron=1.602\times 10^{-19}\:\cancel{C}\times \dfrac{1\: kg}{1.759\times 10^{11}\:\cancel{C}}=9.107\times 10^{-31}\:kg} \tag{2.3.1} \]
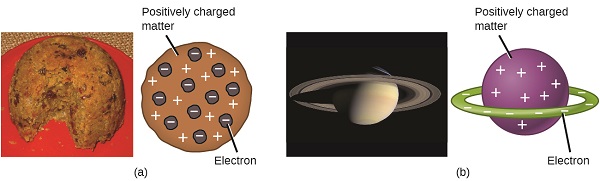
Los científicos ya habían establecido que el átomo no era indivisible como Dalton había creído, y debido al trabajo de Thomson, Millikan y otros, se conocía la carga y masa de las partículas subatómicas negativas, los electrones. Sin embargo, la parte cargada positivamente de un átomo aún no se entendía bien. En 1904, Thomson propuso el modelo de átomos de “pudín de ciruela”, que describía una masa cargada positivamente con una cantidad igual de carga negativa en forma de electrones incrustados en ella, ya que todos los átomos son eléctricamente neutros. Un modelo competidor había sido propuesto en 1903 por Hantaro Nagaoka, quien postuló un átomo similar a Saturno, consistente en una esfera cargada positivamente rodeada por un halo de electrones (Figura\(\PageIndex{3}\)).
El siguiente gran desarrollo en la comprensión del átomo vino de Ernest Rutherford, un físico de Nueva Zelanda que pasó en gran parte su carrera científica en Canadá e Inglaterra. Realizó una serie de experimentos utilizando un haz de partículas alfa de alta velocidad, cargadas positivamente (partículas α) que fueron producidas por la desintegración radiactiva del radio; las partículas α constan de dos protones y dos neutrones (aprenderás más sobre la desintegración radiactiva en el capítulo sobre nuclear química). Rutherford y sus colegas Hans Geiger (más tarde famoso por el contador Geiger) y Ernest Marsden apuntaron un haz de partículas α, cuya fuente estaba incrustada en un bloque de plomo para absorber la mayor parte de la radiación, a una pieza muy delgada de lámina de oro y examinaron la dispersión resultante de las partículas α usando una pantalla luminiscente que resplandeció brevemente donde fueron golpeadas por una partícula α.
¿Qué descubrieron? La mayoría de las partículas pasaron a través de la lámina sin ser desviadas en absoluto. Sin embargo, algunos se desviaron ligeramente, y un número muy pequeño se desviaron casi directamente hacia la fuente (Figura\(\PageIndex{4}\)). Rutherford describió encontrar estos resultados: “Fue el evento más increíble que me haya pasado en mi vida. Fue casi tan increíble como si dispararas un caparazón de 15 pulgadas a un trozo de papel tisú y volviera y te golpeara” 1 (p. 68).
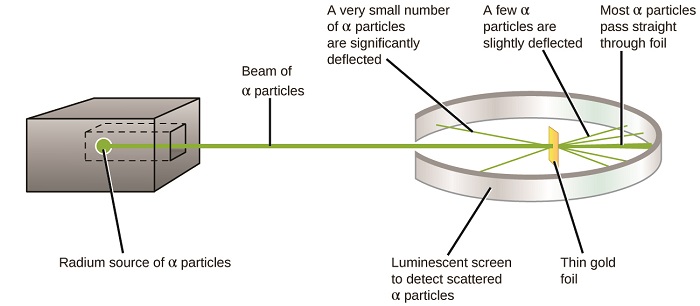
Esto es lo que Rutherford dedujo: Debido a que la mayoría de las partículas α de rápido movimiento pasaron a través de los átomos de oro sin desviarse, debieron haber viajado a través del espacio esencialmente vacío dentro del átomo. Las partículas alfa están cargadas positivamente, por lo que las deflexiones surgieron cuando encontraron otra carga positiva (como las cargas se repelen entre sí). Dado que cargas similares se repelen unas a otras, las pocas partículas α cargadas positivamente que cambiaron de trayectoria abruptamente debieron haber golpeado, o acercarse de cerca, a otro cuerpo que también tenía una carga positiva altamente concentrada. Dado que las deflexiones ocurrieron una pequeña fracción del tiempo, esta carga sólo ocupaba una pequeña cantidad del espacio en la lámina de oro. Analizando una serie de tales experimentos en detalle, Rutherford sacó dos conclusiones:
- El volumen ocupado por un átomo debe consistir en una gran cantidad de espacio vacío.
- Un cuerpo pequeño, relativamente pesado, cargado positivamente, el núcleo, debe estar en el centro de cada átomo.
Este análisis llevó a Rutherford a proponer un modelo en el que un átomo consiste en un núcleo muy pequeño, cargado positivamente, en el que se concentra la mayor parte de la masa del átomo, rodeada por los electrones cargados negativamente, de manera que el átomo es eléctricamente neutro (Figura\(\PageIndex{5}\)).
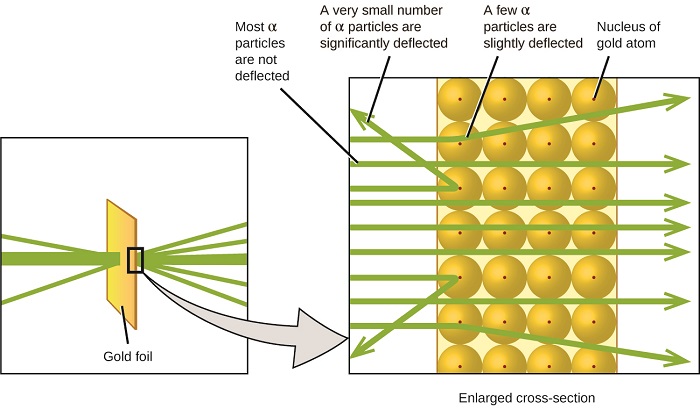
Después de muchos más experimentos, Rutherford también descubrió que los núcleos de otros elementos contienen el núcleo de hidrógeno como un “bloque de construcción”, y nombró a esta partícula más fundamental el protón, la partícula subatómica cargada positivamente que se encuentra en el núcleo. Con una adición, que aprenderá a continuación, este modelo nuclear del átomo, propuesto hace más de un siglo, todavía se utiliza hoy en día.
Otro hallazgo importante fue el descubrimiento de isótopos. Durante principios del siglo XX, los científicos identificaron varias sustancias que parecían ser nuevos elementos, aislándolas de minerales radiactivos. Por ejemplo, a un “nuevo elemento” producido por la desintegración radiactiva del torio se le dio inicialmente el nombre de mesotorio. Sin embargo, un análisis más detallado mostró que el mesotorio era químicamente idéntico al radio (otro producto de desintegración), a pesar de tener una masa atómica diferente. Este resultado, junto con hallazgos similares para otros elementos, llevó al químico inglés Frederick Soddy a darse cuenta de que un elemento podría tener tipos de átomos con diferentes masas que eran químicamente indistinguibles. Estos diferentes tipos se llaman isótopos —átomos del mismo elemento que difieren en masa. Soddy fue galardonado con el Premio Nobel de Química en 1921 por este descubrimiento.
Quedó un rompecabezas: Se sabía que el núcleo contenía casi toda la masa de un átomo, con el número de protones solo proporcionando la mitad, o menos, de esa masa. Se hicieron diferentes propuestas para explicar qué constituía la masa restante, incluyendo la existencia de partículas neutras en el núcleo. Como cabría esperar, detectar partículas sin carga es muy desafiante, y no fue hasta 1932 que James Chadwick encontró evidencia de neutrones, partículas subatómicas no cargadas con una masa aproximadamente la misma que la de los protones. La existencia del neutrón también explicó los isótopos: Difieren en masa porque tienen diferentes números de neutrones, pero son químicamente idénticos porque tienen el mismo número de protones. Esto se explicará con más detalle más adelante en este capítulo.
Resumen
Aunque en realidad nadie ha visto el interior de un átomo, los experimentos han demostrado mucho sobre la estructura atómica. El tubo de rayos catódicos de Thomson mostró que los átomos contienen partículas pequeñas con carga negativa llamadas electrones. Millikan descubrió que existe una carga eléctrica fundamental: la carga de un electrón. El experimento de lámina de oro de Rutherford mostró que los átomos tienen un núcleo pequeño, denso y cargado positivamente; las partículas cargadas positivamente dentro del núcleo se llaman protones. Chadwick descubrió que el núcleo también contiene partículas neutras llamadas neutrones. Soddy demostró que los átomos del mismo elemento pueden diferir en masa; estos se llaman isótopos.
Notas al pie
- Ernest Rutherford, “El desarrollo de la teoría de la estructura atómica”, ed. J. A. Ratcliffe, en Antecedentes de la Ciencia Moderna, eds. Joseph Needham y Walter Pagel, (Cambridge, Reino Unido: Cambridge University Press, 1938), 61—74. Consultado el 22 de septiembre de 2014, https://ia600508.us.archive.org/3/it...e032734mbp.pdf.
Glosario
- partícula alfa (partícula α)
- partícula cargada positivamente que consiste en dos protones y dos neutrones
- electrón
- partícula subatómica cargada negativamente de masa relativamente baja ubicada fuera del núcleo
- isótopos
- átomos que contienen el mismo número de protones pero diferentes números de neutrones
- neutrones
- partícula subatómica no cargada ubicada en el núcleo
- protón
- partícula subatómica cargada positivamente ubicada en el núcleo
- núcleo
- centro masivo, cargado positivamente de un átomo compuesto por protones y neutrones


