Visión general
- Page ID
- 74928
Habilidades para Desarrollar
- Categorizar los diversos tipos de reacciones analizadas como ácido-base o redox
Hasta el momento hemos visto una variedad de tipos de reacción. Esta sección está destinada a ayudarte a encajar todas las piezas juntas. Has visto reacciones de combinación y reacciones de descomposición. A veces estas son las mismas reacciones, simplemente yendo en direcciones opuestas. Así mismo, la disolución y precipitación son procesos opuestos.
Muchos químicos piensan que las reacciones caen en 2 categorías principales: reacciones de tipo ácido-base y reacciones redox. En una reacción de tipo ácido-base, un núcleo subpoblado hace un enlace con un núcleo sobrepoblado, pero los electrones no cambian su lealtad primaria. (Los electrones del núcleo sobrepoblado sí aprecian los mejores beneficios que obtienen del núcleo subpoblado, que tiene más dinero de pensión del que puede gastar en su propia población). En la clásica reacción ácido-base, a los electrones del agua les gusta mucho el oxígeno como hogar, pero se sienten un poco abarrotados y pobres; la alianza con un ion hidrógeno proporciona mucho dinero para hacerlos más felices, y un agradable destino de vacaciones conveniente. En contraste, una reacción redox es cualquier reacción en la que los electrones cambian sus lealtades primarias. Los enlaces entre núcleos pueden cambiar o no, pero los números de oxidación sí cambian. Intenta repasar todos los ejemplos y decidir en qué categoría encajan y por qué.
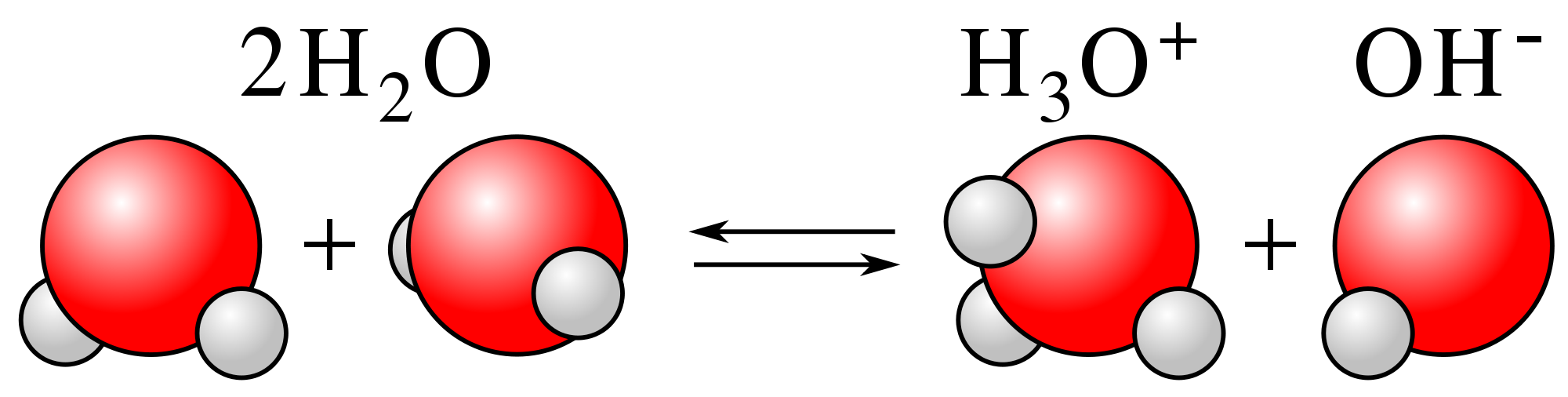
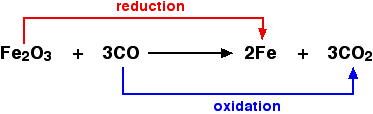
Ejemplo de la reacción ácido-base clásica a la izquierda y una reacción redox a la derecha.
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

