Soluciones, Solvación y Disociación
- Page ID
- 74888
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Habilidades para Desarrollar
- Describir factores que afectan la disolución
Disolución significa el proceso de disolución o formación de una solución. Cuando ocurre la disolución, el soluto se separa en iones o moléculas, y cada ion o molécula está rodeada por moléculas de disolvente. Las interacciones entre las partículas de soluto y las moléculas de disolvente se denomina solvatación. Un ion solvatado o molécula está rodeado por disolvente.
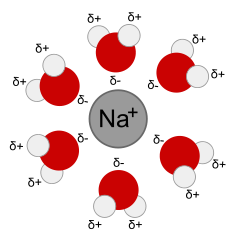
- Un ion de sodio solvatado por agua, de Wikimedia Commons.
Técnicamente un solvente puede significar cualquier cosa que sea el componente más abundante de una mezcla homogénea, pero generalmente significa un líquido volátil en el que las cosas pueden disolverse fácilmente. (Volátil significa que puede evaporarse fácilmente, como el agua o el alcohol). El disolvente más común es el agua. Cuando bucees en el océano, tendrás que enjuagar tu equipo con agua después para eliminar la sal. La sal se disuelve en el agua, se lava, y luego el agua se evapora, dejando el engranaje limpio. Esta es la acción típica de un disolvente.
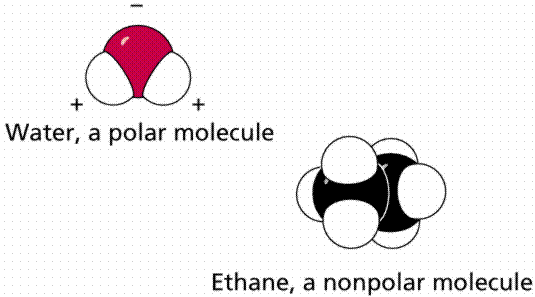
Los solventes son polares o no polares. Un disolvente polar tiene cargas parciales negativas y positivas. Por ejemplo, el agua tiene una carga negativa parcial en O y una carga positiva parcial en H. El símbolo δ significa una carga parcial, menor que la carga en un protón o electrón, como δ+ o δ—. Esto ayuda a que el solvente interactúe con iones (solvatos) y moléculas polares a través de interacciones de Coulomb. Un disolvente no polar es uno que es eléctricamente neutro por todas partes, o casi así. El petróleo, o el gas de tu auto, son ejemplos de líquidos no polares que podrían usarse como solventes. Los solventes no polares solo son buenos para disolver solutos no polares, razón por la cual el agua, la sal y el azúcar no se mezclan con el aceite.
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

