2.4: Nombrar compuestos covalentes
- Page ID
- 78316
- Para nombrar compuestos covalentes que contengan hasta tres elementos.
Al igual que con los compuestos iónicos, el sistema que los químicos han ideado para nombrar compuestos covalentes nos permite escribir la fórmula molecular a partir del nombre y viceversa. En esta y en la siguiente sección, describimos las reglas para nombrar compuestos covalentes simples. Comenzamos con compuestos inorgánicos y luego recurrimos a compuestos orgánicos simples que contienen solo carbono e hidrógeno.
Compuestos inorgánicos binarios
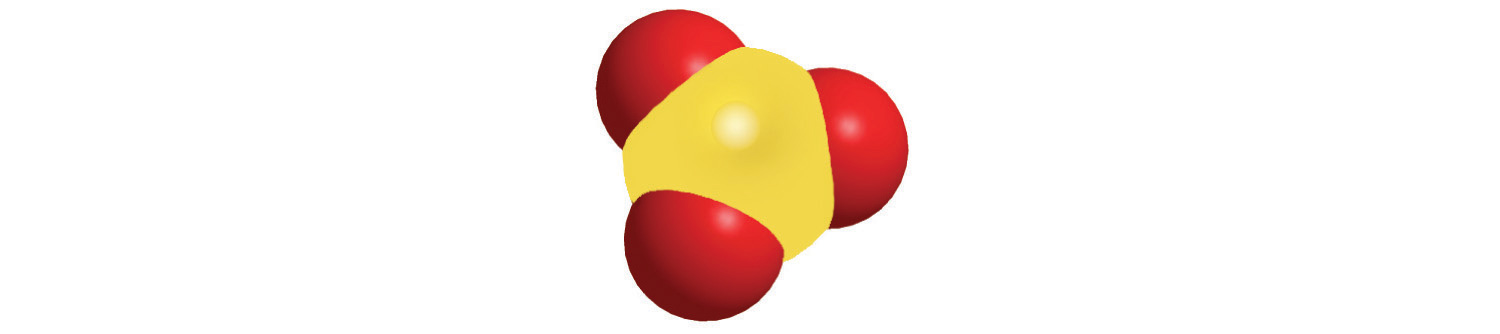
Los compuestos covalentes binarios, es decir, los compuestos covalentes que contienen solo dos elementos, se nombran usando un procedimiento similar al utilizado para nombrar compuestos iónicos simples, pero se agregan prefijos según sea necesario para indicar el número de átomos de cada tipo. El procedimiento, esquematizado en la Figura\(\PageIndex{1}\), utiliza los siguientes pasos:
Figura\(\PageIndex{1}\) Nombrando un Compuesto Inorgánico Covalente
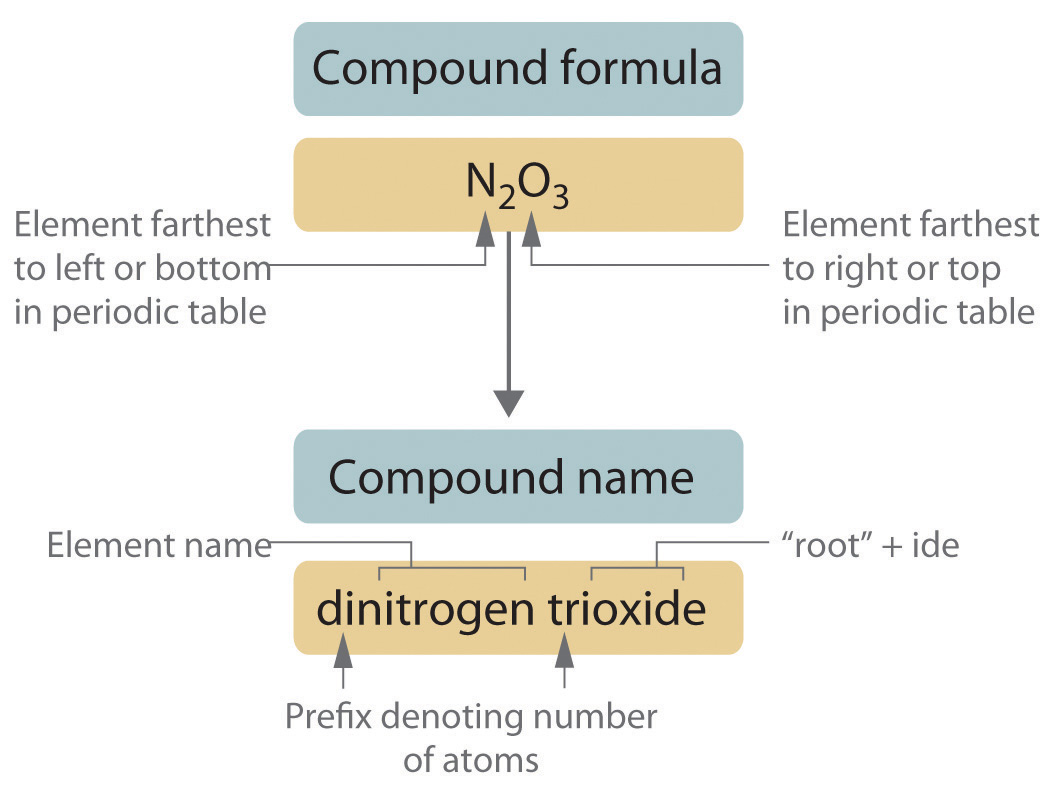
- Colocar los elementos en su orden adecuado.
- El elemento más alejado a la izquierda en la tabla periódica suele denominarse primero. Si ambos elementos están en el mismo grupo, el elemento más cercano a la parte inferior de la columna se nombra primero.
- El segundo elemento se nombra como si fuera un anión monoatómico en un compuesto iónico (aunque no lo sea), con el sufijo -ide unido a la raíz del nombre del elemento.
- Identificar el número de cada tipo de átomo presente.
- Se utilizan prefijos derivados de tallos griegos para indicar el número de cada tipo de átomo en la fórmula unidad (Tabla\(\PageIndex{1}\)). El prefijo mono - (“uno”) se usa sólo cuando es absolutamente necesario para evitar confusiones, así como omitimos el subíndice 1 al escribir fórmulas moleculares.
Para demostrar los pasos 1 y 2a, nombramos HCl como cloruro de hidrógeno (porque el hidrógeno está a la izquierda del cloro en la tabla periódica) y PCl 5 como pentacloruro de fósforo. El orden de los elementos a nombre de BrF 3, trifluoruro de bromo, está determinado por el hecho de que el bromo se encuentra por debajo del flúor en el grupo 17.
\(\PageIndex{1}\)Prefijos de tabla para indicar el número de átomos en nombres químicos
Prefijo Número mono 1 di- 2 tri- 3 tetra 4 penta 5 hexa- 6 hepta 7 octa 8 nona 9 deca- 10 undeca- 11 dodeca 12 - Si una molécula contiene más de un átomo de ambos elementos, entonces se utilizan prefijos para ambos. Así, N 2 O 3 es trióxido de di nitrógeno, como se muestra en la Figura\(\PageIndex{1}\).
- En algunos nombres, se deja caer la a u o final del prefijo para evitar una pronunciación incómoda. Por lo tanto, OsO 4 es tetróxido de osmio en lugar de tetraóxido de osmio.
- Se utilizan prefijos derivados de tallos griegos para indicar el número de cada tipo de átomo en la fórmula unidad (Tabla\(\PageIndex{1}\)). El prefijo mono - (“uno”) se usa sólo cuando es absolutamente necesario para evitar confusiones, así como omitimos el subíndice 1 al escribir fórmulas moleculares.
- Escriba el nombre del compuesto.
- Los compuestos binarios de los elementos con oxígeno generalmente se denominan “óxido de elemento”, con prefijos que indican el número de átomos de cada elemento por unidad de fórmula. Por ejemplo, el CO es monóxido de carbono. La única excepción son los compuestos binarios de oxígeno con flúor, los cuales se denominan fluoruros de oxígeno. (Las razones de esta convención quedarán claras en los capítulos 7 y 8.)
- Ciertos compuestos siempre son llamados por los nombres comunes que se asignaron hace mucho tiempo cuando se usaban nombres en lugar de fórmulas. Por ejemplo, H 2 O es agua (no óxido de dihidrógeno); NH 3 es amoníaco; PH 3 es fosfina; SiH 4 es silano; y B 2 H 6, un dímero de BH 3, es diborano. Para muchos compuestos, el nombre sistemático y el nombre común se utilizan con frecuencia, por lo que debe estar familiarizado con ellos. Por ejemplo, el nombre sistemático para NO es monóxido de nitrógeno, pero es mucho más comúnmente llamado óxido nítrico. Del mismo modo, el N 2 O se suele llamar óxido nitroso en lugar de monóxido de dinitrógeno. Observe que los sufijos - ic y - ous son los mismos que se utilizan para los compuestos iónicos.
Tenga en cuenta el patrón
Comience con el elemento en el extremo izquierdo en la tabla periódica y trabaje hacia la derecha. Si dos o más elementos están en el mismo grupo, comience con el elemento inferior y trabaje.
Escriba el nombre de cada compuesto covalente binario.
- SF 6
- N 2 O 4
- ClO 2
Dado: fórmula molecular
Preguntado por: nombre del compuesto
Estrategia:
A Enumerar los elementos en orden según sus posiciones en la tabla periódica. Identificar el número de cada tipo de átomo en la fórmula química y luego usar Tabla\(\PageIndex{1}\) para determinar los prefijos necesarios.
B Si el compuesto contiene oxígeno, siga el paso 3a. De no ser así, decidir si usar el nombre común o el nombre sistemático.
Solución
- A Debido a que el azufre está a la izquierda del flúor en la tabla periódica, el azufre se nombra primero. Debido a que solo hay un átomo de azufre en la fórmula, no se necesita ningún prefijo. B Hay, sin embargo, seis átomos de flúor, por lo que usamos el prefijo para seis: hexa - (Tabla\(\PageIndex{1}\)). El compuesto es hexafluoruro de azufre.
- A Debido a que el nitrógeno está a la izquierda del oxígeno en la tabla periódica, el nitrógeno se nombra primero. Debido a que más de un átomo de cada elemento está presente, se necesitan prefijos para indicar el número de átomos de cada uno. Según Table\(\PageIndex{1}\), el prefijo para dos es di -, y el prefijo para cuatro es tetra -. B El compuesto es tetroxido de dinitrógeno (omitiendo el a in tetra - según la etapa 2c) y se utiliza como componente de algunos combustibles para cohetes.
- A Aunque el oxígeno se encuentra a la izquierda del cloro en la tabla periódica, no se nombra primero porque ClO 2 es un óxido de un elemento distinto al flúor (paso 3a). En consecuencia, el cloro se nombra primero, pero no es necesario un prefijo porque cada molécula tiene sólo un átomo de cloro. B Debido a que hay dos átomos de oxígeno, el compuesto es un dióxido. Así, el compuesto es dióxido de cloro. Es ampliamente utilizado como sustituto del cloro en plantas de tratamiento de agua municipales ya que, a diferencia del cloro, no reacciona con compuestos orgánicos en el agua para producir compuestos clorados potencialmente tóxicos.
Escriba el nombre de cada compuesto covalente binario.
- SI 7
- N 2 O 5
- DE 2
- Responder
-
- heptafluoruro de yodo
- pentóxido de dinitrógeno
- difluoruro de oxígeno
Escriba la fórmula para cada compuesto covalente binario.
- trióxido de azufre
- pentóxido de diyodo
Dado: nombre del compuesto
Preguntado por: fórmula
Estrategia:
Enumere los elementos en el mismo orden que en la fórmula, use Tabla\(\PageIndex{1}\) para identificar el número de cada tipo de átomo presente, y luego indicar esta cantidad como subíndice a la derecha de ese elemento al escribir la fórmula.
Solución
- El azufre no tiene prefijo, lo que significa que cada molécula tiene solo un átomo de azufre. El prefijo tri - indica que hay tres átomos de oxígeno. Por lo tanto, la fórmula es SO 3. El trióxido de azufre se produce industrialmente en grandes cantidades como intermediario en la síntesis de ácido sulfúrico.
- El prefijo di - te dice que cada molécula tiene dos átomos de yodo, y el prefijo penta - indica que hay cinco átomos de oxígeno. La fórmula es así I 2 O 5, un compuesto utilizado para eliminar el monóxido de carbono del aire en los respiradores.
Escriba la fórmula para cada compuesto covalente binario.
- tetracloruro de silicio
- decafluoruro de disulfur
- Responder
-
- SiCl 4
- S 2 F 10
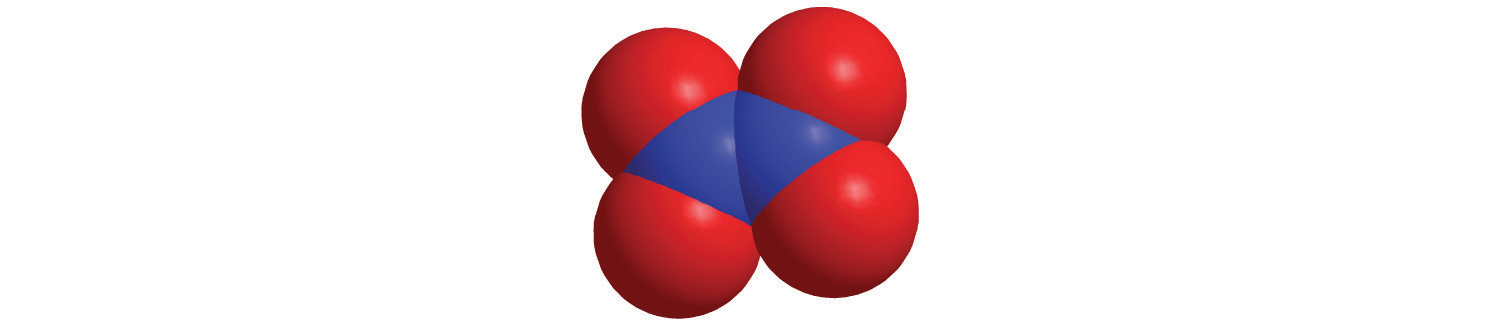
Las estructuras de algunos de los compuestos del Ejemplo 8 y del Ejemplo 9 se muestran en la Figura\(\PageIndex{2}\) junto con la ubicación del “átomo central” de cada compuesto en la tabla periódica. Puede parecer que las composiciones y estructuras de tales compuestos son completamente aleatorias, pero esto no es cierto. Después de haber dominado el material en el Capítulo 7 y Capítulo 8, podrá predecir las composiciones y estructuras de compuestos de este tipo con un alto grado de precisión.
Figura\(\PageIndex{2}\) Las estructuras de algunos compuestos inorgánicos covalentes y las ubicaciones de los “átomos centrales” en la tabla periódica
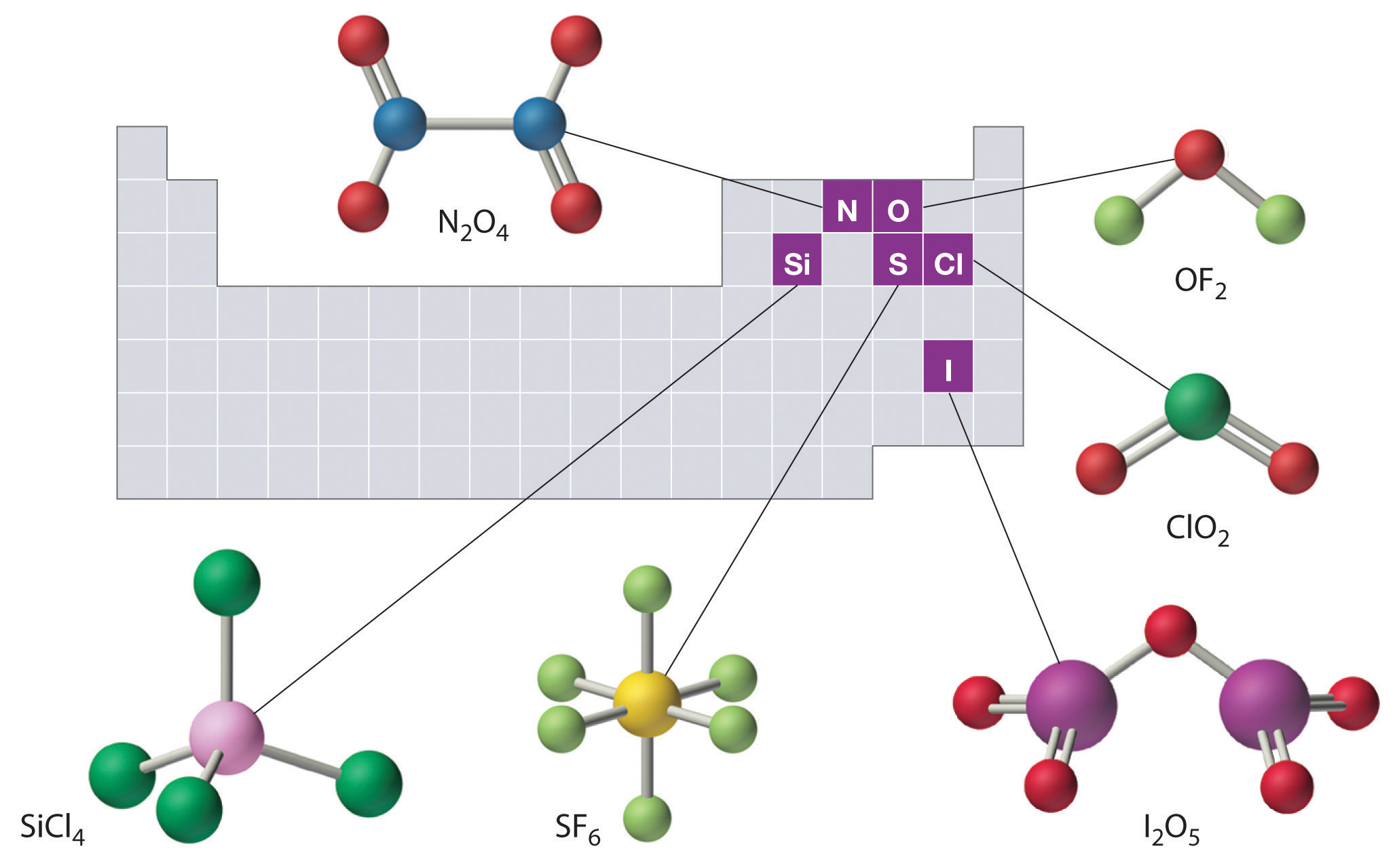
Las composiciones y estructuras de los compuestos inorgánicos covalentes no son aleatorias. Como aprenderás en el Capítulo 7 y Capítulo 8, se pueden predecir a partir de las ubicaciones de los átomos componentes en la tabla periódica.
Hidrocarburos
Aproximadamente un tercio de los compuestos producidos industrialmente son compuestos orgánicos. Todos los organismos vivos están compuestos por compuestos orgánicos, como lo es la mayor parte de los alimentos que consumes, los medicamentos que tomas, las fibras en la ropa que usas y los plásticos en los materiales que usas. En la sección 2.1 se introdujeron dos compuestos orgánicos: metano (CH 4) y metanol (CH 3 OH). Estos y otros compuestos orgánicos aparecen frecuentemente en discusiones y ejemplos a lo largo de este texto.
La detección de compuestos orgánicos es útil en muchos campos. En una aplicación recientemente desarrollada, los científicos han ideado un nuevo método llamado “degradómica material” para permitir monitorear la degradación de libros antiguos y documentos históricos. A medida que el papel envejece, produce un familiar “olor a libro viejo” a partir de la liberación de compuestos orgánicos en forma gaseosa. La composición del gas depende del tipo original de papel utilizado, la encuadernación de un libro y los medios aplicados. Al analizar estos gases orgánicos y aislar los componentes individuales, los conservacionistas son más capaces de determinar el estado de un objeto y aquellos libros y documentos que más necesitan protección inmediata.
La clase más simple de compuestos orgánicos son los hidrocarburos, que consisten enteramente en carbono e hidrógeno. El petróleo y el gas natural son mezclas complejas y naturales de muchos hidrocarburos diferentes que proporcionan materias primas para la industria química. Las cuatro clases principales de hidrocarburos son los alcanos, que contienen solo enlaces simples carbono-hidrógeno y carbono-carbono; los alquenos, que contienen al menos un doble enlace carbono-carbono; los alquinos, que contienen al menos un triple enlace carbono-carbono; y los hidrocarburos aromáticos, que suelen contener anillos de seis átomos de carbono que pueden ser dibujados con enlaces simples y dobles alternantes. Los alcanos también se denominan hidrocarburos saturados, mientras que los hidrocarburos que contienen múltiples enlaces (alquenos, alquinos y aromáticos) son insaturados.
Alcanos
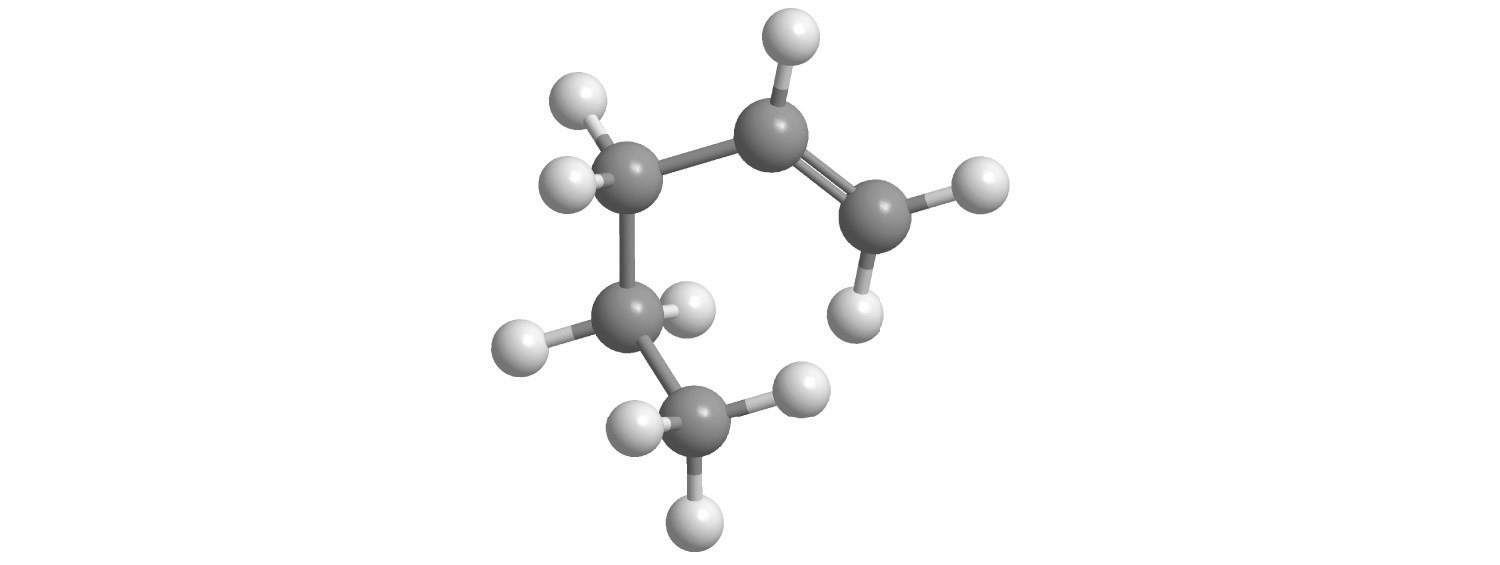
El alcano más simple es el metano (CH 4), un gas incoloro e inodoro que es el componente principal del gas natural. En alcanos más grandes cuyos átomos de carbono están unidos en una cadena no ramificada (alcanos de cadena lineal), cada átomo de carbono está unido a como máximo otros dos átomos de carbono. Las estructuras de dos alcanos simples se muestran en la Figura\(\PageIndex{3}\), y los nombres y fórmulas estructurales condensadas para los primeros 10 alcanos de cadena lineal están en la Tabla\(\PageIndex{2}\). Los nombres de todos los alcanos terminan en - ano, y sus puntos de ebullición aumentan a medida que aumenta el número de átomos de carbono.
Figura\(\PageIndex{3}\) Alcanos de Cadena Recta con Dos y Tres Átomos de Carbono

Tabla\(\PageIndex{2}\) Los primeros 10 alcanos de cadena recta
| Nombre | Número de átomos de carbono | Fórmula molecular | Fórmula estructural condensada | Punto de ebullición (°C) | Usos |
|---|---|---|---|---|---|
| metano | 1 | CH 4 | CH 4 | −162 | constituyente de gas natural |
| etano | 2 | C 2 H 6 | CH 3 CH 3 | −89 | constituyente de gas natural |
| propano | 3 | C 3 H 8 | CH 3 CH 2 CH 3 | −42 | gas embotellado |
| butano | 4 | C 4 H 10 | CH 3 CH 2 CH 2 CH 3 o CH 3 (CH 2) 2 CH 3 | 0 | encendedores, gas embotellado |
| pentano | 5 | C 5 H 12 | CH 3 (CH 2) 3 CH 3 | 36 | solvente, gasolina |
| hexano | 6 | C 6 H 14 | CH 3 (CH 2) 4 CH 3 | 69 | solvente, gasolina |
| heptano | 7 | C 7 H 16 | CH 3 (CH 2) 5 CH 3 | 98 | solvente, gasolina |
| octano | 8 | C 8 H 18 | CH 3 (CH 2) 6 CH 3 | 126 | gasolina |
| nonano | 9 | C 9 H 20 | CH 3 (CH 2) 7 CH 3 | 151 | gasolina |
| decano | 10 | C 10 H 22 | CH 3 (CH 2) 8 CH 3 | 174 | queroseno |
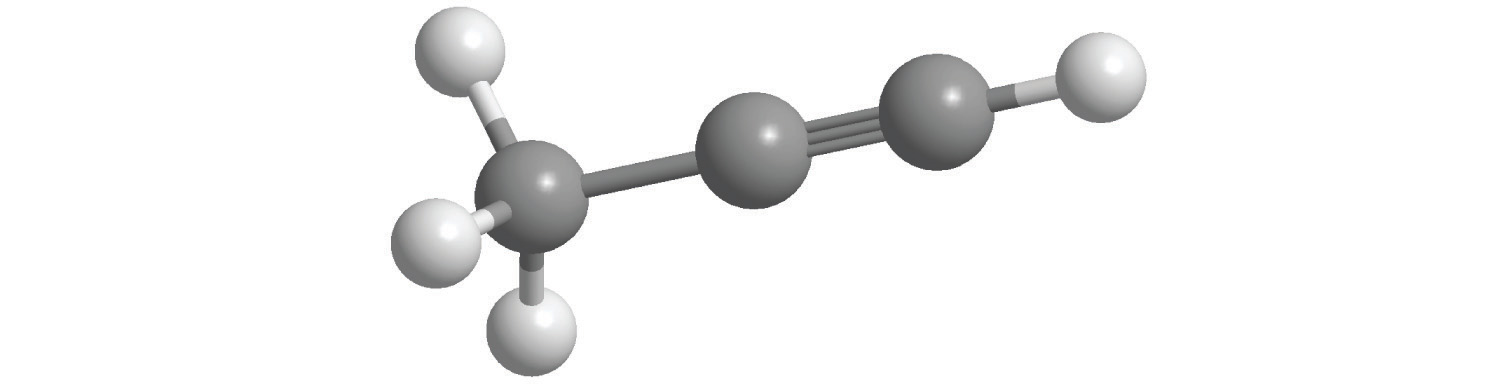
Los alcanos con cuatro o más átomos de carbono pueden tener más de una disposición de átomos. Los átomos de carbono pueden formar una sola cadena no ramificada, o la cadena primaria de átomos de carbono puede tener una o más cadenas más cortas que forman ramas. Por ejemplo, el butano (C 4 H 10) tiene dos estructuras posibles. El butano normal (generalmente llamado n-butano) es CH 3 CH 2 CH 2 CH 3, en el que los átomos de carbono forman una sola cadena no ramificada. En contraste, la fórmula estructural condensada para el isobutano es (CH 3) 2 CHCH 3, en la que la cadena primaria de tres átomos de carbono tiene una cadena de un carbono que se ramifica en el carbono central. Las representaciones tridimensionales de ambas estructuras son las siguientes:
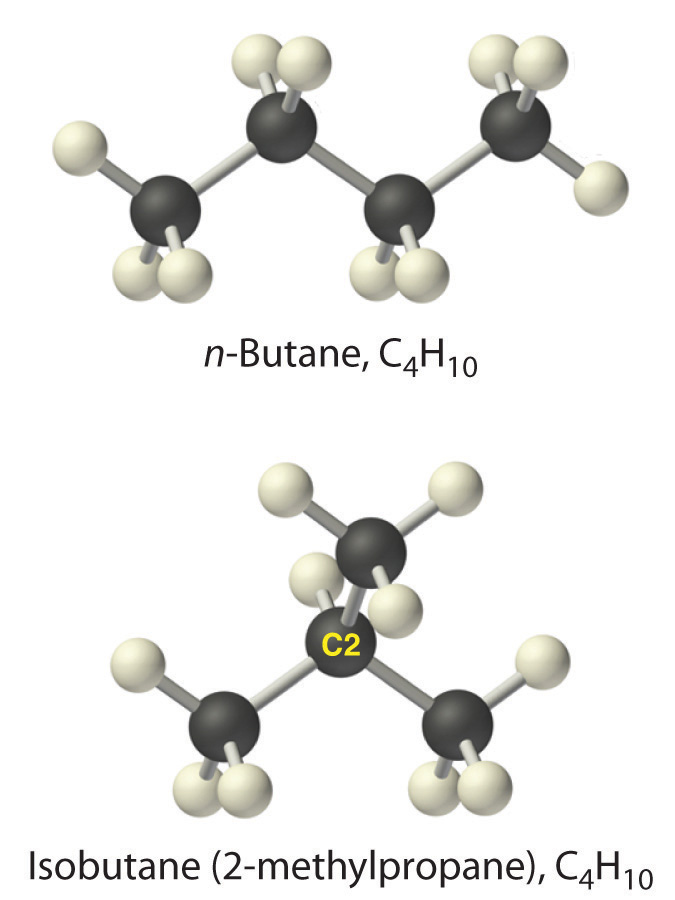
Los nombres sistemáticos de hidrocarburos ramificados utilizan el menor número posible para indicar la posición de la rama a lo largo de la cadena de carbono lineal más larga de la estructura. Así, el nombre sistemático para isobutano es 2-metilpropano, lo que indica que un grupo metilo (una rama que consiste en —CH 3) está unido al segundo carbono de una molécula de propano. De igual manera, aprenderá en la Sección 2.6 que uno de los principales componentes de la gasolina se llama comúnmente isooctano; su estructura es la siguiente:

Como se puede ver, el compuesto tiene una cadena de cinco átomos de carbono, por lo que es un derivado del pentano. Hay dos ramas del grupo metilo en un átomo de carbono y un grupo metilo en otro. El uso de los números más bajos posibles para las ramas da 2,2,4-trimetilpentano para el nombre sistemático de este compuesto.
Alquenos
Los alquenos más simples son etileno, C 2 H 4 o CH 2 =CH 2, y propileno, C 3 H 6 o CH 3 CH=CH 2 (parte (a) en la Figura 2.16). Los nombres de alquenos que tienen más de tres átomos de carbono utilizan los mismos tallos que los nombres de los alcanos (Cuadro 2.7) pero terminan en - ene en lugar de - ane.
Una vez más, es posible más de una estructura para alquenos con cuatro o más átomos de carbono. Por ejemplo, un alqueno con cuatro átomos de carbono tiene tres estructuras posibles. Uno es CH 2 =CHCH 2 CH 3 (1-buteno), que tiene el doble enlace entre el primer y segundo átomos de carbono en la cadena. Las otras dos estructuras tienen el doble enlace entre el segundo y tercer átomos de carbono y son formas de CH 3 CH=CHCH 3 (2-buteno). Los cuatro átomos de carbono del 2-buteno se encuentran en el mismo plano, por lo que hay dos estructuras posibles (parte (a) en la Figura\(\PageIndex{4}\)). Si los dos grupos metilo están en el mismo lado del doble enlace, el compuesto es cis-2-buteno (del latín cis, que significa “en el mismo lado”). Si los dos grupos metilo están en lados opuestos del doble enlace, el compuesto es trans -2-buteno (del latín trans, que significa “a través”). Estas son moléculas claramente diferentes: el cis -2-buteno se funde a −138.9°C, mientras que el trans--2-buteno se funde a −105.5°C.
Figura\(\PageIndex{4}\) Algunos Simple (a) Alquenos, (b) Alquinos, y (c) Hidrocarburos Cíclicos
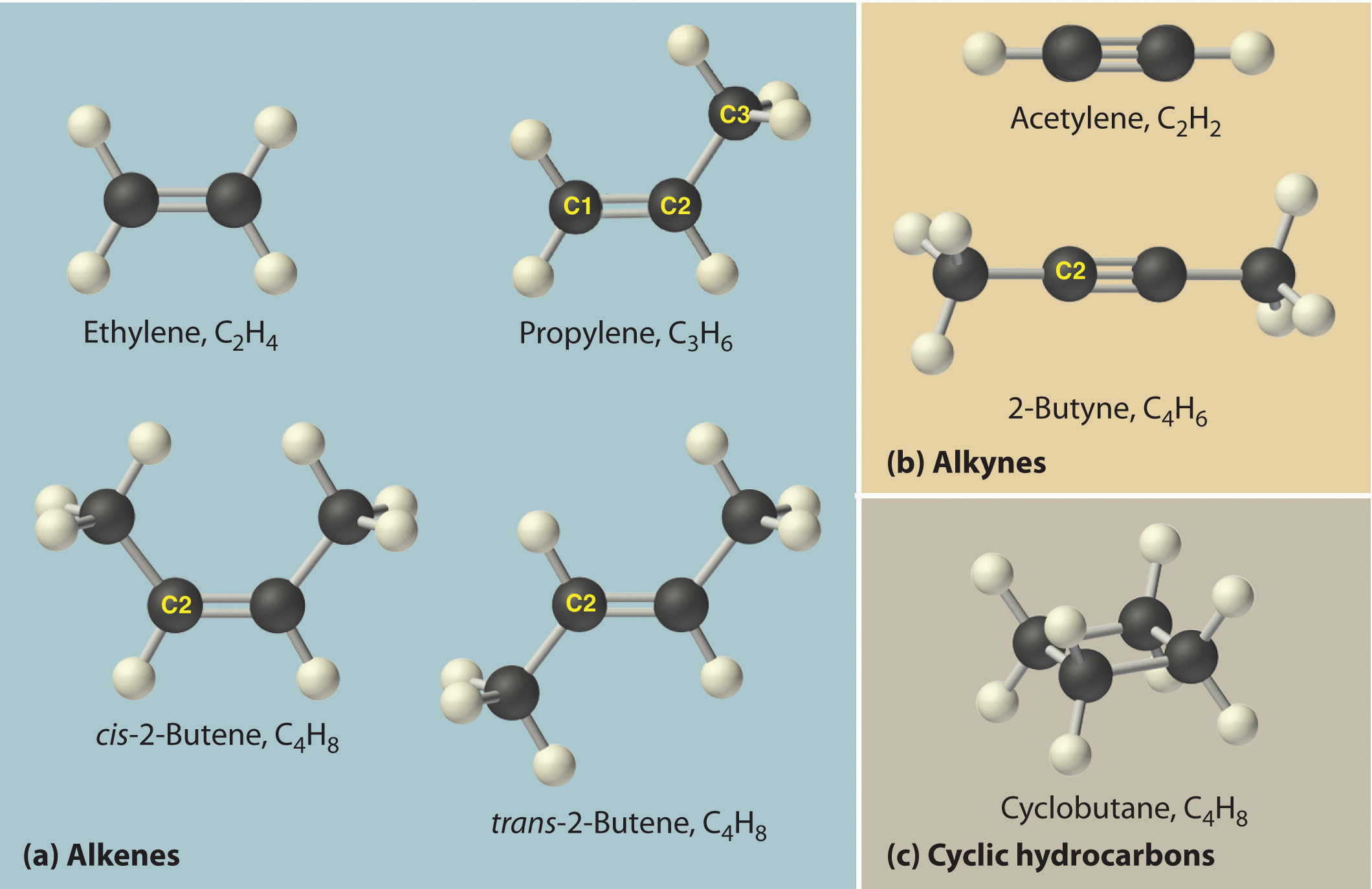
Las posiciones de los átomos de carbono en la cadena están indicadas por C1 o C2.
Así como un número indica las posiciones de las ramas en un alcano, el número en nombre de un alqueno especifica la posición del primer átomo de carbono del doble enlace. El nombre se basa en el número más bajo posible a partir de cualquier extremo de la cadena carbonada, por lo que CH 3 CH 2 CH=CH 2 se llama 1-buteno, no 3-buteno. Nótese que CH 2 =CHCH 2 CH 3 y CH 3 CH 2 CH=CH 2 son diferentes formas de escribir la misma molécula (1-buteno) en dos orientaciones diferentes.
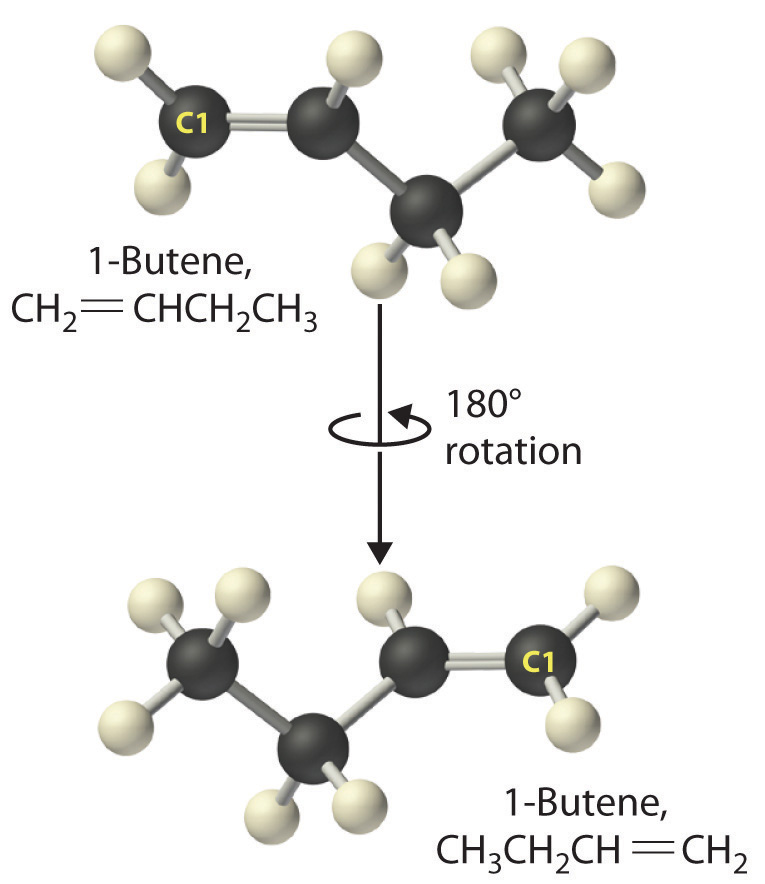
El nombre de un compuesto no depende de su orientación. Como se ilustra para el 1-buteno, tanto las fórmulas estructurales condensadas como los modelos moleculares muestran diferentes orientaciones de una misma molécula. No dejes que la orientación te engañe; debes ser capaz de reconocer la misma estructura sin importar cuál sea su orientación.
Tenga en cuenta el patrón
Las posiciones de grupos o enlaces múltiples siempre se indican con el menor número posible.
Alquinos
El alquino más simple es el acetileno, C 2 H 2 o HC=CH (parte (b) en la Figura\(\PageIndex{4}\)). Debido a que una mezcla de acetileno y oxígeno se quema con una llama lo suficientemente caliente (>3000°C) para cortar metales como el acero endurecido, el acetileno es ampliamente utilizado en el corte y soldadura de antorchas. Los nombres de otros alquinos son similares a los de los alcanos correspondientes pero terminan en - yne. Por ejemplo, HC=CCH 3 es propino, y CH 3 C=CCH 3 es 2-butino porque el enlace múltiple comienza en el segundo átomo de carbono.
Tenga en cuenta el patrón
El número de enlaces entre los átomos de carbono en un hidrocarburo se indica en el sufijo:
- alk ane: solo enlaces simples carbono-carbono
- alqueno: al menos un doble enlace carbono-carbono
- alquina: al menos un triple enlace carbono-carbono
Hidrocarburos cíclicos
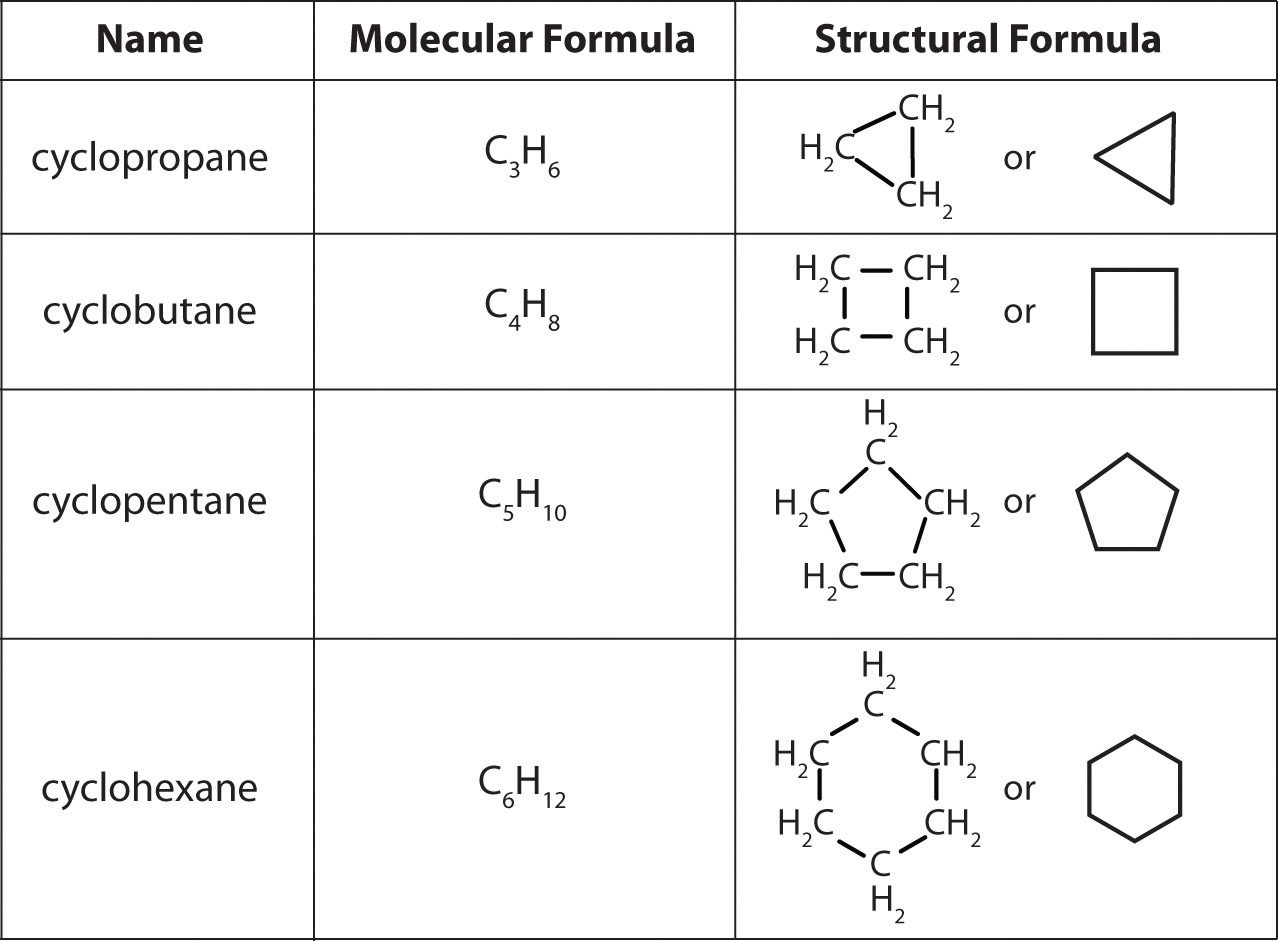
En un hidrocarburo cíclico, los extremos de una cadena hidrocarbonada están conectados para formar un anillo de átomos de carbono unidos covalentemente. Los hidrocarburos cíclicos se nombran adjuntando el prefijo ciclo - al nombre del alcano, el alqueno o el alquino. Los alcanos cíclicos más simples son el ciclopropano (C 3 H 6), un gas inflamable que también es un potente anestésico, y el ciclobutano (C 4 H 8) (parte (c) en la Figura\(\PageIndex{4}\)). La forma más común de dibujar las estructuras de alcanos cíclicos es esbozar un polígono con el mismo número de vértices que hay átomos de carbono en el anillo; cada vértice representa una unidad CH 2. Las estructuras de los cicloalcanos que contienen de tres a seis átomos de carbono se muestran esquemáticamente en la Figura\(\PageIndex{5}\).
Figura\(\PageIndex{5}\) Los Cicloalcanos Simples
Hidrocarburos Aromáticos
Los alcanos, alquenos, alquinos e hidrocarburos cíclicos generalmente se denominan hidrocarburos alifáticos. El nombre proviene del griego aleífar, que significa “aceite”, porque los primeros ejemplos se extrajeron de grasas animales. En contraste, los primeros ejemplos de hidrocarburos aromáticos, también llamados arenos, se obtuvieron por la destilación y degradación de resinas altamente perfumadas (así aromáticas) de árboles tropicales.
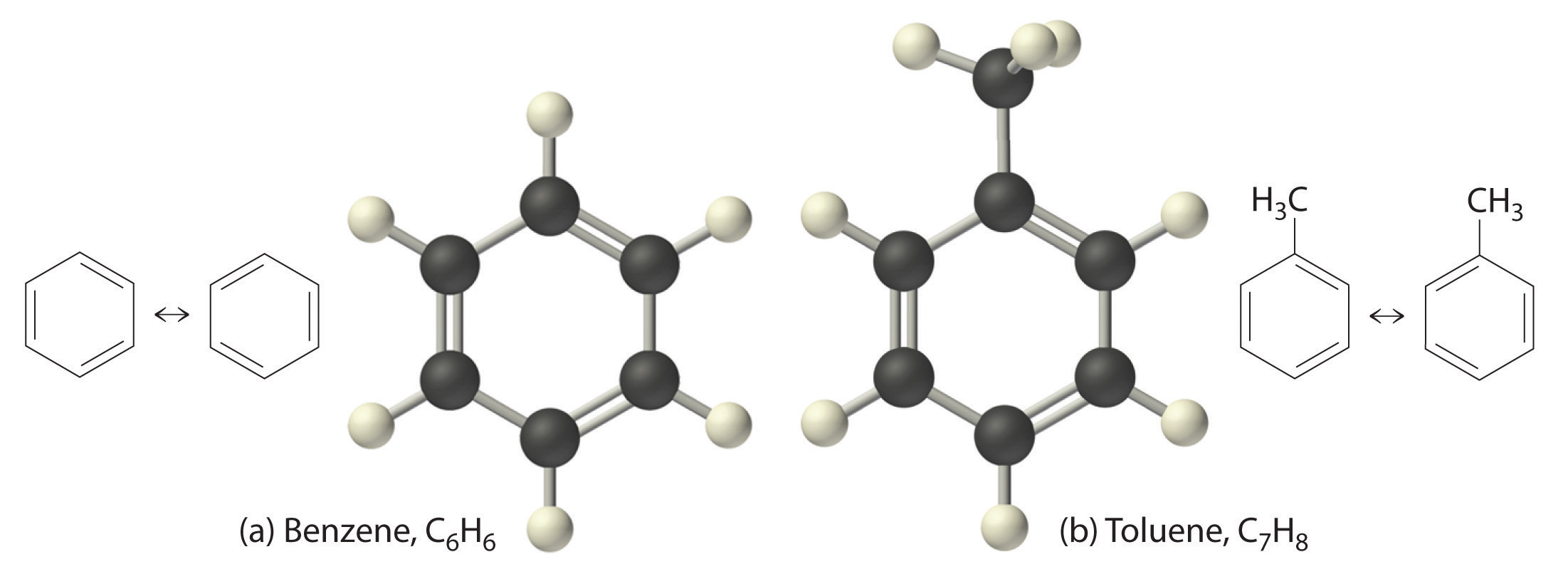
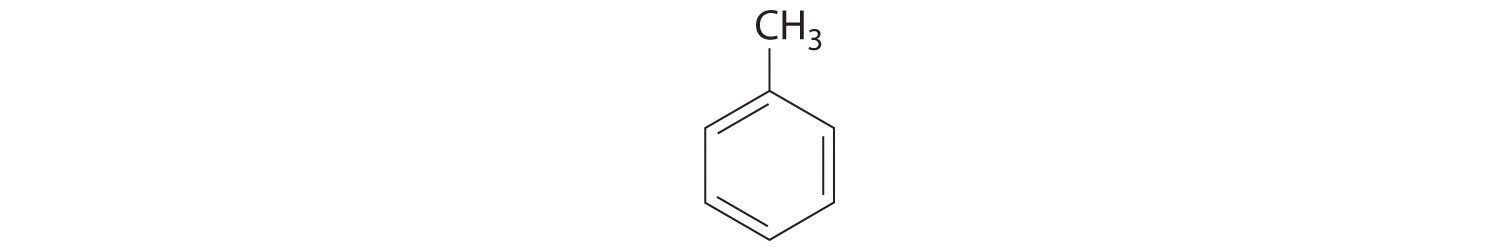
El hidrocarburo aromático más simple es el benceno (C 6 H 6), el cual se obtuvo primero de un destilado de carbón. La palabra aromático ahora se refiere al benceno y compuestos estructuralmente similares. Como se muestra en la parte (a) de la Figura\(\PageIndex{6}\), es posible dibujar la estructura del benceno de dos maneras diferentes pero equivalentes, dependiendo de qué átomos de carbono estén conectados por dobles enlaces o enlaces sencillos. El tolueno es similar al benceno, excepto que un átomo de hidrógeno es reemplazado por un grupo —CH 3; tiene la fórmula C 7 H 8 (parte (b) en la Figura\(\PageIndex{6}\)). Como pronto aprenderá, el comportamiento químico de los compuestos aromáticos difiere del comportamiento de los compuestos alifáticos. El benceno y el tolueno se encuentran en la gasolina, y el benceno es el material de partida para preparar sustancias tan diversas como la aspirina y el nylon.
Figura\(\PageIndex{6}\) Dos Hidrocarburos Aromáticos: (a) Benceno y (b) Tolueno
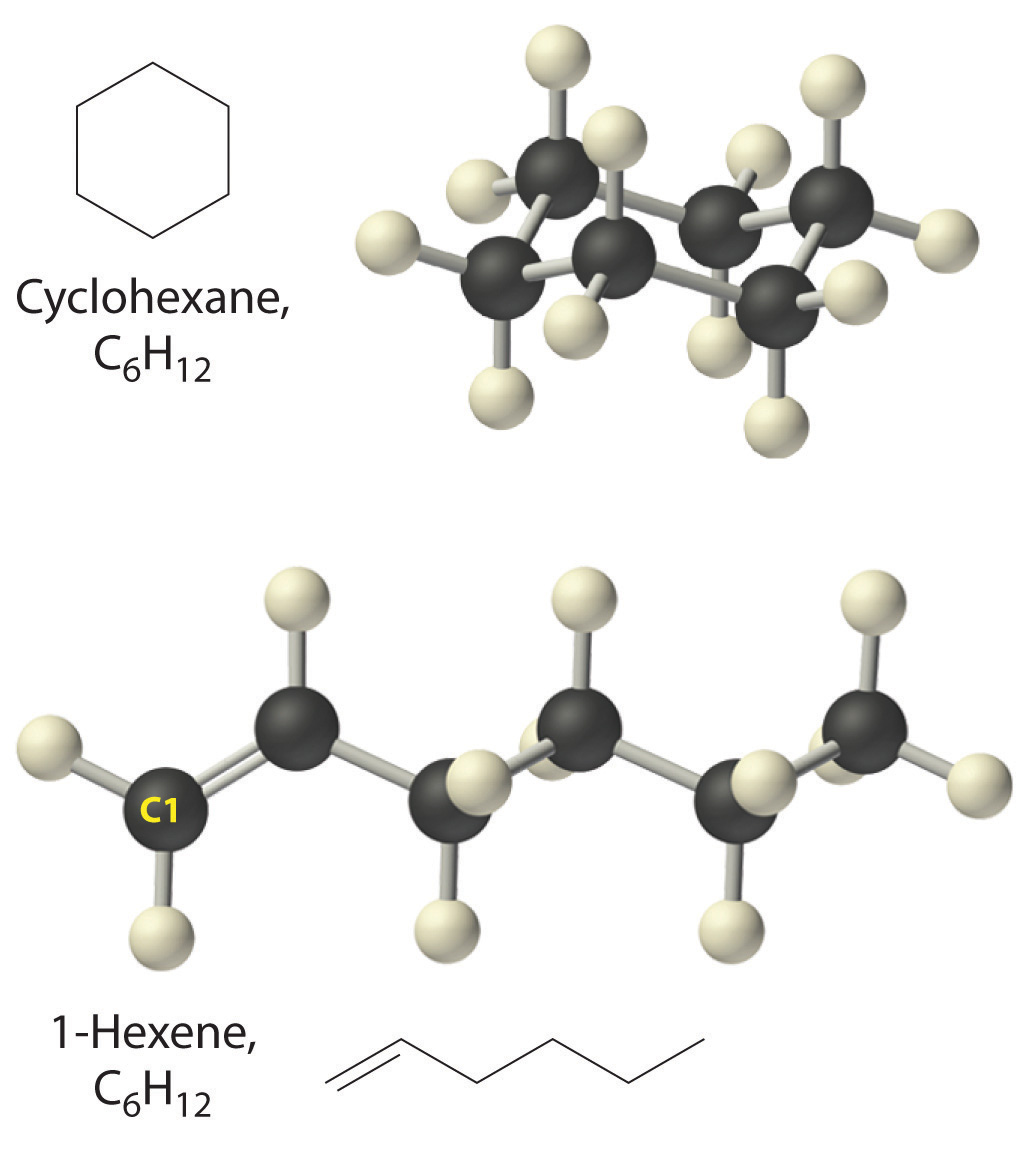
La Figura\(\PageIndex{7}\) ilustra dos de las estructuras moleculares posibles para hidrocarburos que tienen seis átomos de carbono. Como puede ver, los compuestos con la misma fórmula molecular pueden tener estructuras muy diferentes.
Figura\(\PageIndex{7}\) Dos Hidrocarburos con la Fórmula Molecular C 6 H 12
Escriba la fórmula estructural condensada para cada hidrocarburo.
- n-heptano
- 2-penteno
- 2-butirino
- cicloocteno
Dado: nombre de hidrocarburo
Preguntado por: fórmula estructural condensada
Estrategia:
A Usa el prefijo para determinar el número de átomos de carbono en la molécula y si es cíclica. A partir del sufijo, determinar si hay múltiples enlaces presentes.
B Identificar la posición de cualquier enlace múltiple a partir del número o números en el nombre y luego escribir la fórmula estructural condensada.
Solución
- A El prefijo hept -nos dice que este hidrocarburo tiene siete átomos de carbono, y n - indica que los átomos de carbono forman una cadena lineal. El sufijo - ane dice que es un alcano, sin dobles o triples enlaces carbono-carbono. B La fórmula estructural condensada es CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3, que también se puede escribir como CH 3 (CH 2) 5 CH 3.
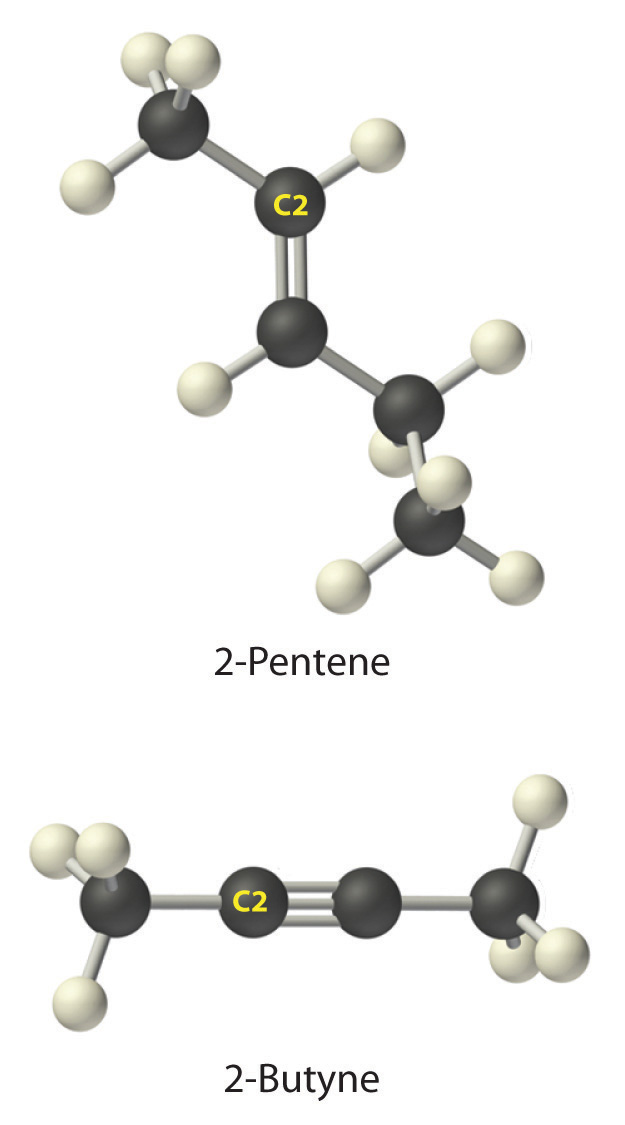
- A El prefijo pent -nos dice que este hidrocarburo tiene cinco átomos de carbono, y el sufijo -ene indica que es un alqueno, con un doble enlace carbono-carbono. B El 2- nos dice que el doble enlace comienza en el segundo carbono de la cadena de cinco átomos de carbono. La fórmula estructural condensada del compuesto es, por lo tanto, CH 3 CH=CHCH 2 CH 3.
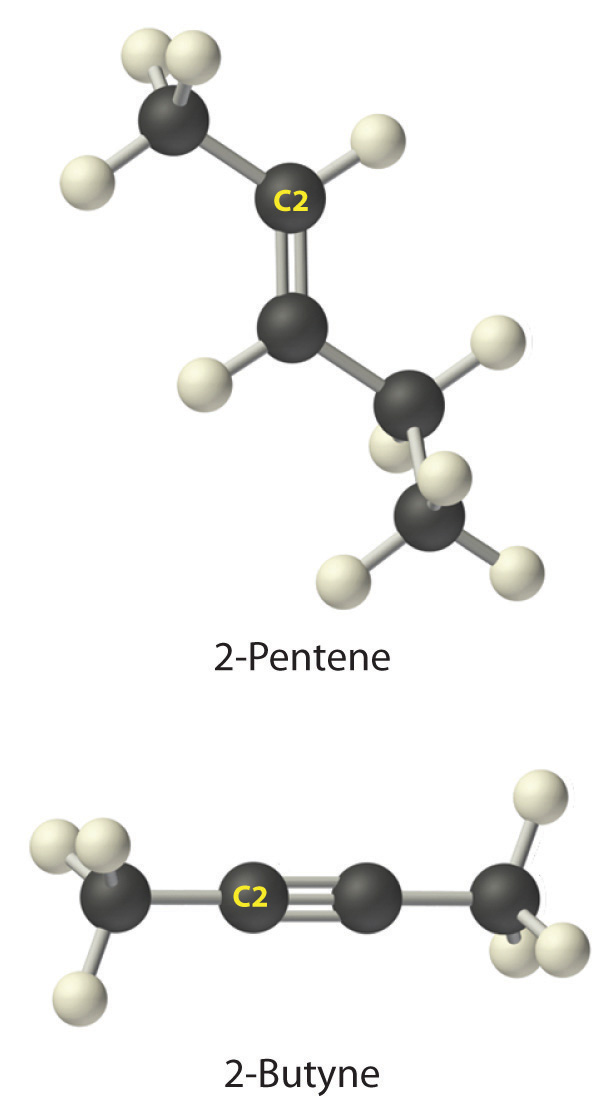
- A El prefijo pero -nos dice que el compuesto tiene una cadena de cuatro átomos de carbono, y el sufijo -yne indica que tiene un triple enlace carbono-carbono. B El 2- nos dice que el triple enlace comienza en el segundo carbono de la cadena de cuatro átomos de carbono. Entonces la fórmula estructural condensada para el compuesto es CH 3 C=CCH 3.
- A El prefijo ciclo -nos dice que este hidrocarburo tiene una estructura anular, y oct - indica que contiene ocho átomos de carbono, los cuales podemos dibujar como
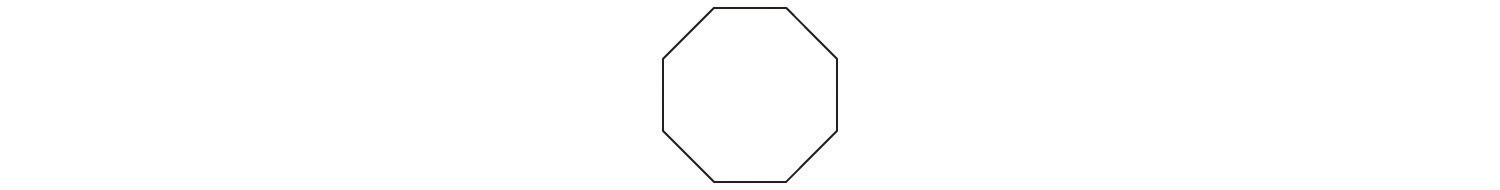
El sufijo - ene nos dice que el compuesto contiene un doble enlace carbono-carbono, pero ¿en qué parte del anillo colocamos el doble enlace? B Porque los ocho átomos de carbono son idénticos, no importa. Podemos dibujar la estructura del cicloocteno como
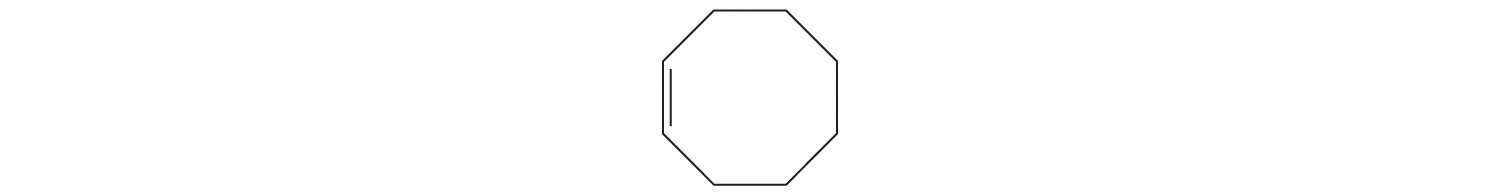
Escriba la fórmula estructural condensada para cada hidrocarburo.
- n -octano
- 2-hexeno
- 1-heptino
- ciclopentano
- Responder
-
- CH 3 (CH 2) 6 CH 3
- CH 3 CH=CHCH 2 CH 2 CH 3
- HC=C (CH 2) 4 CH 3

El nombre general para un grupo de átomos derivados de un alcano es un grupo alquilo. El nombre de un grupo alquilo se deriva del nombre del alcano añadiendo el sufijo - yl. Así, el fragmento —CH 3 es un grupo metilo, el fragmento —CH 2 CH 3 es un grupo etilo, y así sucesivamente, donde el guion representa un enlace sencillo a algún otro átomo o grupo. De igual manera, los grupos de átomos derivados de hidrocarburos aromáticos son grupos arilo, que a veces tienen nombres inesperados. Por ejemplo, el fragmento —C 6 H 5 se deriva del benceno, pero se le llama grupo fenilo. En fórmulas y estructuras generales, los grupos alquilo y arilo a menudo se abrevian como R.
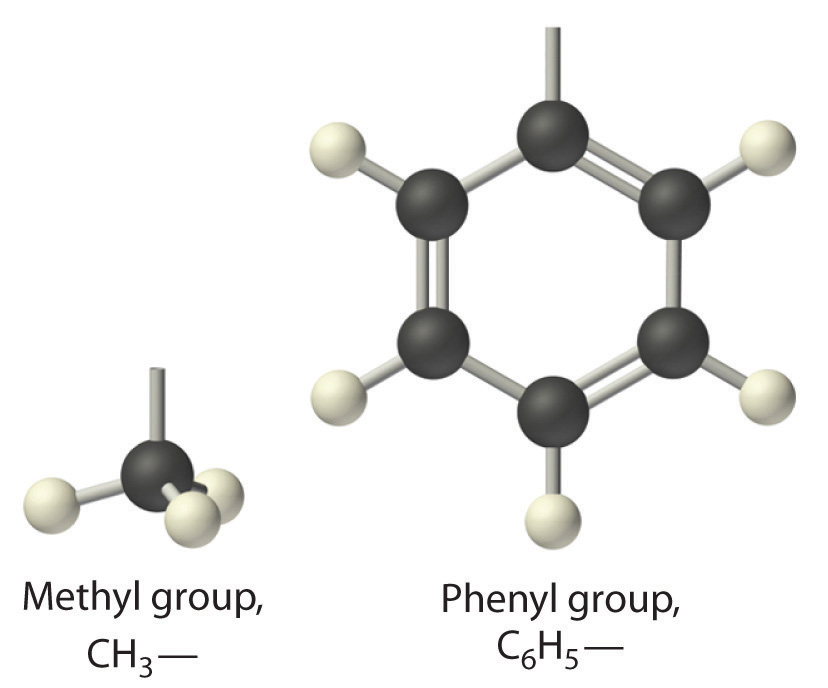
Estructuras de grupos alquilo y arilo. El grupo metilo es un ejemplo de un grupo alquilo, y el grupo fenilo es un ejemplo de un grupo arilo.
Alcoholes
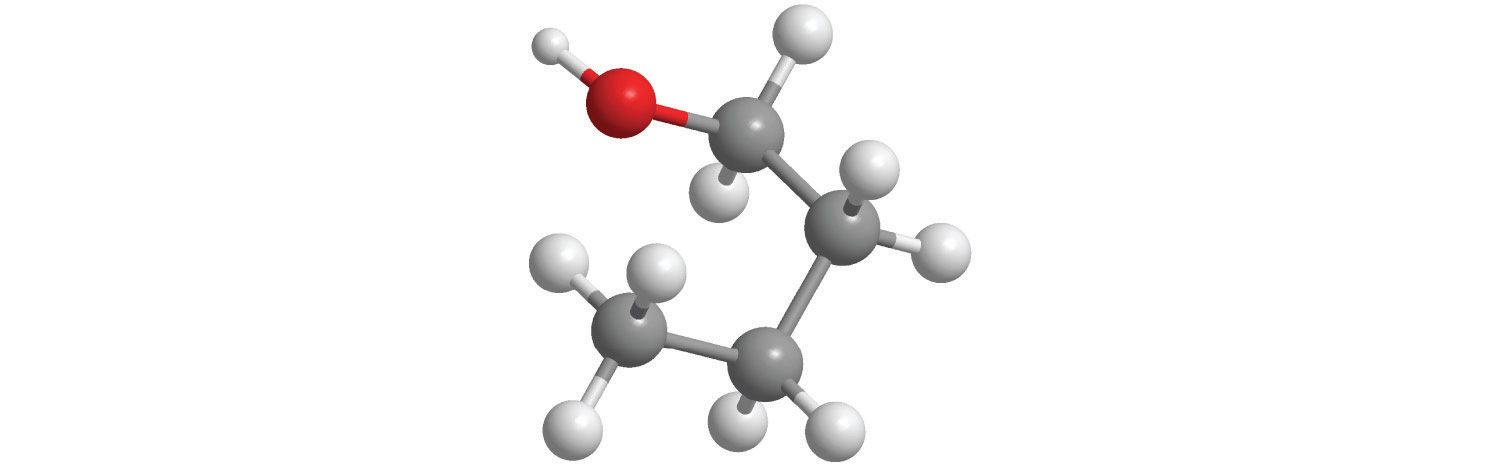
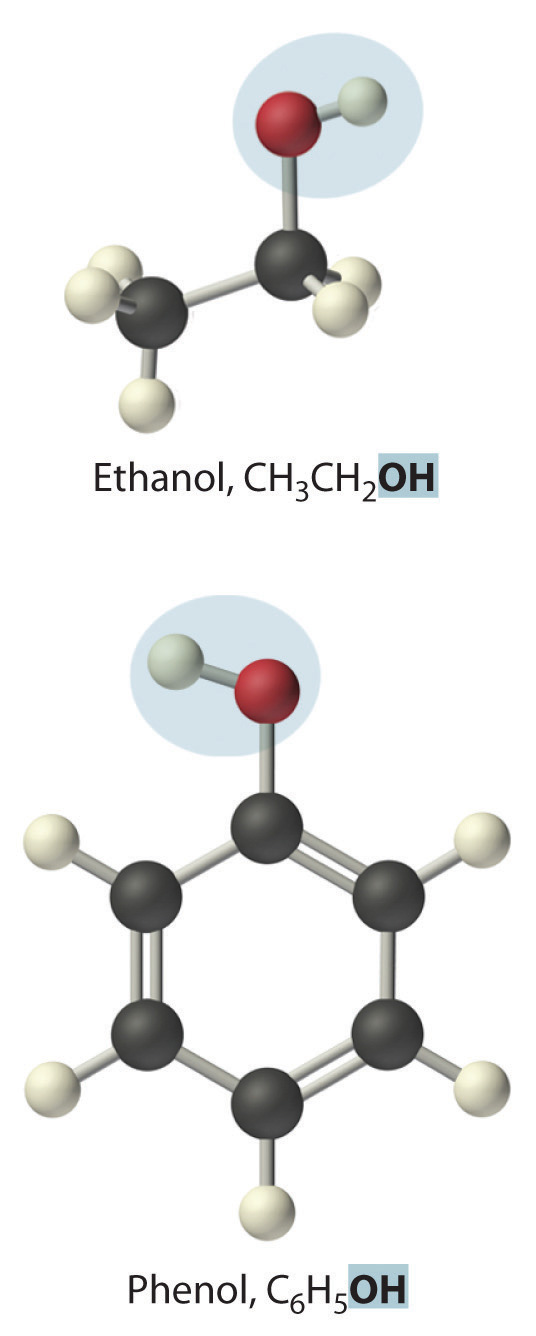
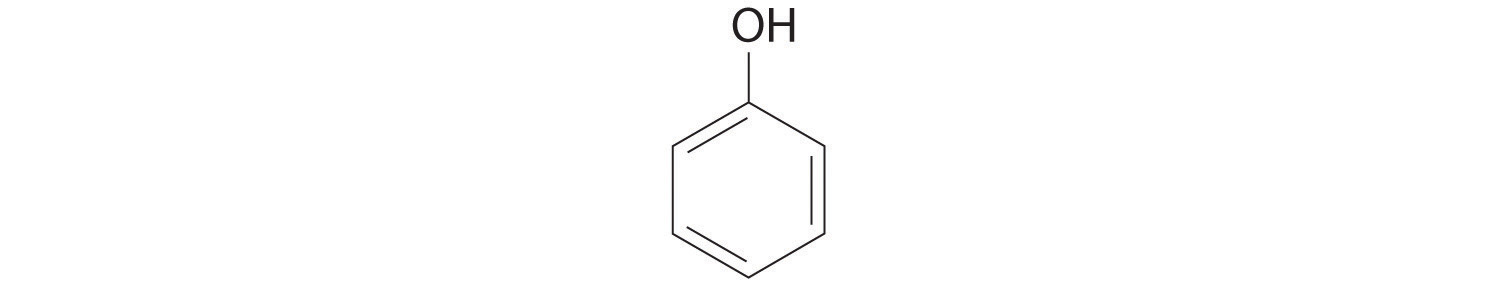
Reemplazar uno o más átomos de hidrógeno de un hidrocarburo con un grupo -OH da un alcohol, representado como ROH. El alcohol más simple (CH 3 OH) se llama metanol (su nombre sistemático) o alcohol metílico (su nombre común) (ver “Diferentes formas de representar la estructura de una molécula”). El metanol es el anticongelante en los líquidos limpiaparabrisas de automóviles, y también se usa como combustible eficiente para autos de carreras, sobre todo en los 500 de Indianápolis. El etanol (o alcohol etílico, CH 3 CH 2 OH) es familiar como el alcohol en las bebidas fermentadas o destiladas, como la cerveza, el vino y el whisky; también se usa como aditivo de gasolina (Sección 2.6). El alcohol más simple derivado de un hidrocarburo aromático es C 6 H 5 OH, fenol (acortado de alcohol fenílico), un potente desinfectante utilizado en algunos medicamentos para el dolor de garganta y enjuagues bucales.
El etanol, que es fácil de obtener de los procesos de fermentación, se ha utilizado con éxito como combustible alternativo durante varias décadas. Si bien es un combustible “verde” cuando se deriva de plantas, es un sustituto imperfecto de los combustibles fósiles porque es menos eficiente que la gasolina. Además, debido a que el etanol absorbe agua de la atmósfera, puede corroer los sellos de un motor. Así se están desarrollando otros tipos de procesos que utilizan bacterias para crear alcoholes más complejos, como el octanol, que son más eficientes energéticamente y que tienen una menor tendencia a absorber agua. A medida que los científicos intentan reducir la dependencia de la humanidad de los combustibles fósiles, el desarrollo de estos llamados biocombustibles es un área de investigación particularmente activa.
Resumen
Los compuestos inorgánicos covalentes son nombrados por un procedimiento similar al utilizado para los compuestos iónicos, usando prefijos para indicar los números de átomos en la fórmula molecular. Los compuestos orgánicos más simples son los hidrocarburos, que contienen solo carbono e hidrógeno. Los alcanos contienen solo enlaces simples carbono-hidrógeno y carbono-carbono, los alquenos contienen al menos un doble enlace carbono-carbono y los alquinos contienen uno o más triples enlaces carbono-carbono. Los hidrocarburos también pueden ser cíclicos, con los extremos de la cadena conectados para formar un anillo. Colectivamente, los alcanos, alquenos y alquinos se denominan hidrocarburos alifáticos. Los hidrocarburos aromáticos, o arenos, son otra clase importante de hidrocarburos que contienen anillos de átomos de carbono relacionados con la estructura del benceno (C 6 H 6). Un derivado de un alcano o un areno del que se ha eliminado un átomo de hidrógeno se denomina grupo alquilo o grupo arilo, respectivamente. Los alcoholes son otra clase común de compuestos orgánicos, que contienen un grupo -OH unido covalentemente a un grupo alquilo o un grupo arilo (a menudo abreviado R).
LLAVE PARA LLEVAR
- Los compuestos inorgánicos covalentes se denominan mediante un procedimiento similar al utilizado para los compuestos iónicos, mientras que los hidrocarburos utilizan un sistema basado en el número de enlaces entre los átomos de carbono.
PROBLEMAS CONCEPTUALES
- El benceno (C 6 H 6) es un compuesto orgánico y el KCl es un compuesto iónico. La suma de las masas de los átomos en cada fórmula empírica es aproximadamente la misma. ¿Cómo esperarías que se compararan los dos con respecto a cada una de las siguientes? ¿Qué especies están presentes en el vapor de benceno?
- punto de fusión
- tipo de unión
- velocidad de evaporación
- estructura
- ¿Se puede clasificar un compuesto inorgánico como hidrocarburo? ¿Por qué o por qué no?
- ¿El compuesto NaHCO 3 es un hidrocarburo? ¿Por qué o por qué no?
- Nombra cada compuesto.
- NiO
- TiO 2
- N 2 O
- CS 2
- SO 3
- NF 3
- SF 6
- Nombra cada compuesto.
- HgCl 2
- SI 5
- N 2 O 5
- Cl 2 O
- HgS
- PCl 5
- Para cada fórmula estructural, escriba la fórmula condensada y el nombre del compuesto.
- Para cada fórmula estructural, escriba la fórmula condensada y el nombre del compuesto.
- ¿Esperaría que PCl 3 sea un compuesto iónico o un compuesto covalente? Explica tu razonamiento.
- ¿Qué distingue a un hidrocarburo aromático de un hidrocarburo alifático?
- Las siguientes fórmulas generales representan clases específicas de hidrocarburos. Consulte Tabla\(\PageIndex{2}\) y Figura\(\PageIndex{4}\) e identifique las clases.
- C n H 2 n + 2
- C n H 2 n
- C n H 2 n − 2
- Usando R para representar un grupo alquilo o arilo, mostrar la estructura general de un
- alcohol.
- fenol.
Contestar
-
- ROH (donde R es un grupo alquilo)
- ROH (donde R es un grupo arilo)
PROBLEMAS NUMÉRICOS
- Escribe la fórmula para cada compuesto.
- monóxido de dinitrógeno
- tetrafluoruro de silicio
- tricloruro de boro
- trifluoruro de nitrógeno
- tribromuro de fósforo
- Escribe la fórmula para cada compuesto.
- trióxido de dinitrógeno
- pentafluoruro de yodo
- tribromuro de boro
- difluoruro de oxígeno
- tricloruro de arsénico
- Escribe la fórmula para cada compuesto.
- seleniuro de talio (I)
- óxido de neptunio (IV)
- sulfuro de hierro (II)
- cianuro de cobre (I)
- tricloruro de nitrógeno
- Nombra cada compuesto.
- RuO 4
- PbO 2
- MoF 6
- Hg 2 (NO 3) 2·2H 2 O
- WCl 4
- Nombra cada compuesto.
- NbO 2
- MoS 2
- P 4 S 10
- Cu 2 O
- ReF 5
- Dibuja la estructura de cada compuesto.
- propino
- etanol
- n-hexano
- ciclopropano
- benceno
- Dibuja la estructura de cada compuesto.
- 1-buteno
- 2-pentino
- cicloheptano
- tolueno
- fenol
RESPUESTAS
-
- N 2 O
- SiF 4
- BCl 3
- NF 3
- PBr 3
-
- Tl 2 Se
- nPO 2
- FeS
- CuCn
- NCl 3
-
- óxido de niobio (IV)
- sulfuro de molibdeno (IV)
- Tetraphosphorus decasulfuro
- óxido de cobre (I)
- fluoruro de renio (V)
-

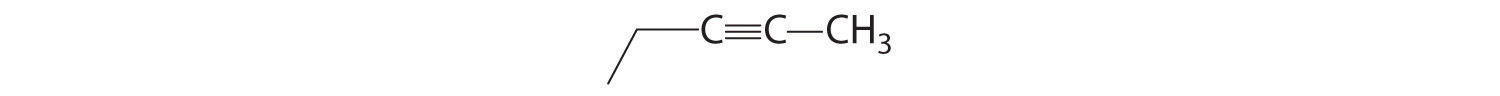

 _
_