12.3: Estructuras de Compuestos Binarios Simples
- Page ID
- 78051
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Utilizar la relación catión:radio anión para predecir las estructuras de compuestos binarios simples.
- Comprender cómo los rayos X son difractados por los sólidos cristalinos.
Las estructuras de la mayoría de los compuestos binarios se pueden describir usando los esquemas de empaque que acabamos de discutir para metales. Para ello, generalmente nos enfocamos en el arreglo en el espacio de las especies más grandes presentes. En sólidos iónicos, esto generalmente significa los aniones, que generalmente están dispuestos en una simple red cúbica, bcc, fcc o hcp. A menudo, sin embargo, las redes aniónicas no están realmente “empaquetadas”; debido a que los cationes son lo suficientemente grandes como para apuntalarlos un poco, los aniones no están realmente en contacto entre sí. En los compuestos iónicos, los cationes suelen ocupar los “agujeros” entre los aniones, equilibrando así la carga negativa. Se requiere la relación de cationes a aniones dentro de una celda unitaria para lograr la neutralidad eléctrica y corresponde a la estequiometría masiva del compuesto.
Estructuras comunes de compuestos binarios
Como se muestra en la parte (a) de la Figura 12.8, una simple celosía cúbica de aniones contiene solo un tipo de orificio, ubicado en el centro de la celda unitaria. Debido a que este agujero es equidistante de los ocho átomos en las esquinas de la celda unitaria, se le llama agujero cúbico. Por lo tanto, un átomo o ion en un agujero cúbico tiene un número de coordinación de 8.

Figura 12.8 Agujeros en Celosías Cúbicas. Las tres ilustraciones muestran (a) el agujero cúbico que se encuentra en el centro de una simple celosía cúbica de aniones, (b) las ubicaciones de los agujeros octaédricos en una celosía cúbica centrada en la cara de aniones, y (c) las ubicaciones de los agujeros tetraédricos en una celosía cúbica centrada en la cara de aniones.
Muchos compuestos iónicos con cationes relativamente grandes y una relación catión:anión 1:1 tienen esta estructura, que se denomina estructura de cloruro de cesio (Figura 12.9) porque CsCl es un ejemplo común.Los químicos de estado sólido tienden a describir las estructuras de nuevos compuestos en términos de la estructura de un conocido compuesto de referencia. De ahí que a menudo leerás declaraciones como “El Compuesto X posee la estructura de cloruro de cesio (o cloruro de sodio, etc.)” para describir la estructura del compuesto X. Observe en la Figura 12.9 que los planos z = 0 y z = 1.0 son siempre los mismos. Esto se debe a que el plano z = 1.0 de una celda unitaria se convierte en el plano z = 0 de la siguiente. La celda unitaria en CsCl contiene un solo ion Cs+ así como un ion 8×18Cl−=1Cl-, para una estequiometría global de CsCl. La estructura de cloruro de cesio es más común para sustancias iónicas con cationes relativamente grandes, en las que la relación del radio del catión al radio del anión se encuentra en el rango que se muestra en la Tabla 12.2.

Figura 12.9: Estructura del Cloruro de Cesio. El ion Cs+ ocupa el agujero cúbico en el centro de un cubo de iones Cl−. Los dibujos de la derecha son secciones transversales horizontales a través de la celda unitaria en la parte inferior (z = 0) y a medio camino entre la parte inferior y la parte superior (z = 0.5). Una sección transversal superior (z = 1) es idéntica a z = 0. Tales secciones transversales a menudo nos ayudan a visualizar más fácilmente la disposición de los átomos o iones en la celda unitaria.
Cuadro 12.2 Relación entre la Relación Catión:Radio Aniónico y el Sitio Ocupado por los Cationes
| Rango aproximado de relación de catión:radio anión | Agujero ocupado por catión | Número de Coordinación Catiónica |
|---|---|---|
| 0.225—0.414 | tetraédrico | 4 |
| 0.414—0.732 | octaédrico | 6 |
| 0.732—1.000 | cúbico | 8 |
| Nota |
|---|
| Los cationes muy grandes ocupan agujeros cúbicos, los cationes de tamaño intermedio ocupan agujeros octaédricos y los cationes pequeños ocupan agujeros tetraédricos en la red aniónica. |
En contraste, una matriz cúbica (fcc) centrada en la cara de átomos o aniones contiene dos tipos de agujeros: agujeros octaédricos, uno en el centro de la celda unitaria más uno compartido en el medio de cada borde (parte (b) en la Figura 12.8), y agujeros tetraédricos, ubicados entre un átomo en una esquina y los tres átomos en los centros de las caras adyacentes (parte (c) en la Figura 12.8). Como se muestra en la Tabla 12.2, la relación entre el radio del catión y el radio del anión es el determinante más importante de si los cationes ocupan los agujeros cúbicos en una red de aniones cúbicos o los agujeros octaédricos o tetraédricos en una red fcc de aniones. Los cationes muy grandes ocupan agujeros cúbicos en una red de aniones cúbicos, los cationes de tamaño intermedio tienden a ocupar los agujeros octaédricos en una red aniónica fcc, y los cationes relativamente pequeños tienden a ocupar los agujeros tetraédricos en una red aniónica fcc. En general, los cationes más grandes tienen números de coordinación mayores que los cationes pequeños.
La estructura más común basada en una red fcc es la estructura de cloruro de sodio (Figura 12.10), que contiene una matriz fcc de iones Cl- con iones Na+ en todos los agujeros octaédricos. Podemos entender la estructura del cloruro de sodio reconociendo que llenar todos los agujeros octaédricos en una red fcc de iones Cl− con iones Na+ da un total de 4 iones Cl− (uno en cada cara da 6×\({1 \over 2} \) =3 más uno en cada esquina da 8×\({1 \over 8} \) =1, para un total de 4) y 4 iones Na+ (uno en cada borde da 12×\({1 \over 4}\) =3 más uno en el medio, para un total de 4). El resultado es una celda unitaria eléctricamente neutra y una estequiometría de NaCl. Como se muestra en la Figura 12.10, los iones Na+ en la estructura de cloruro de sodio también forman una red fcc. La estructura del cloruro de sodio se ve favorecida para sustancias con dos átomos o iones en una proporción 1:1 y en las que la relación del radio del catión al radio del anión está entre 0.414 y 0.732. Se observa en muchos compuestos, incluyendo MgO y TiC.

Figura 12.10 La Estructura del Cloruro de Sodio. En NaCl, los iones Na+ ocupan los agujeros octaédricos en una red fcc de iones Cl−, dando como resultado una matriz fcc de iones Na+ también.
La estructura mostrada en la Figura 12.11 se denomina estructura de blenda de zinc, por el nombre común del mineral ZnS. Se produce cuando el catión en una sustancia con una relación catión:anión 1:1 es mucho menor que el anión (si la relación catión:radio anión es menor que aproximadamente 0.414). Por ejemplo, ZnS contiene una red fcc de iones S2 -, y la relación de radio catión:anión es solo de aproximadamente 0.40, por lo que predecimos que el catión ocuparía un agujero tetraédrico o un orificio octaédrico. De hecho, los relativamente pequeños cationes Zn 2 + ocupan los agujeros tetraédricos en la celosía. Si los 8 orificios tetraédricos de la celda unitaria estuvieran ocupados por iones Zn 2 +, sin embargo, la celda unitaria contendría 4 iones S 2− y 8 iones Zn 2 +, dando una fórmula de Zn 2 S y una carga neta de +4 por celda unitaria. En consecuencia, los iones Zn 2 + ocupan cada dos agujeros tetraédricos, como se muestra en la Figura 12.11, dando un total de 4 iones Zn 2 + y 4 S 2− por celda unitaria y una fórmula de ZnS. La estructura de la blenda de zinc da como resultado un número de coordinación de 4 por cada ion Zn 2 + y una disposición tetraédrica de los cuatro iones S2 − alrededor de cada ion Zn 2 +.

Figura 12.11 La Estructura de la Blende de Zinc. Los iones Zn 2 + ocupan todos los demás orificios tetraédricos en la matriz fcc de iones S2-. Cada ion Zn 2 + está rodeado por cuatro iones S2- en una disposición tetraédrica.
| Ejemplo 3 |
|---|
|
a. Si todos los agujeros tetraédricos en una red fcc de aniones están ocupados por cationes, ¿cuál es la estequiometría del compuesto resultante? b. Utilizar los radios iónicos indicados en la Figura 7.9 para identificar un compuesto plausible que contenga oxígeno con esta estequiometría y estructura. Dado: celosía, ocupación de agujeros tetraédricos y radios iónicos Preguntado por: estequiometría e identidad Estrategia:
Solución: a. A la Figura 12.8 se muestra que los orificios tetraédricos en una celda unitaria fcc de aniones están localizados completamente dentro de la celda unitaria, para un total de ocho (uno cerca de cada esquina). B Debido a que los orificios tetraédricos se encuentran completamente dentro de la celda unitaria, hay ocho cationes por celda unitaria. Se calculó previamente que una célula unitaria fcc de aniones contiene un total de cuatro aniones por celda unitaria. La estequiometría del compuesto es por lo tanto M 8 Y 4 o, reducida a los números enteros más pequeños, M 2 Y. b. C La estequiometría M 2 Y es consistente con una red compuesta por iones M+ e iones Y 2−. Si el anión es O 2− (radio iónico 140pm), necesitamos una monocación con un radio no mayor a aproximadamente 140 × 0.414 = 58 pm para encajar en los agujeros tetraédricos. Según la Figura 7.9, ninguna de las monocaciones tiene un radio tan pequeño; por lo tanto, la posibilidad más probable es Li + a las 76 pm. Por lo tanto, esperamos que Li 2 O tenga una estructura que es una matriz fcc de aniones O 2− con cationes Li + en todos los agujeros tetraédricos. |
| Ejercicio 1 |
|---|
|
Si solo la mitad de los agujeros octaédricos en una red fcc de aniones están llenos de cationes, ¿cuál es la estequiometría del compuesto resultante? Respuesta: MX 2; un ejemplo de tal compuesto es el cloruro de cadmio (CdCl 2), en el que los sitios catiónicos vacíos forman planos que atraviesan el cristal. |
Examinamos solo otra estructura de las muchas que se conocen, la estructura de la perovskita. Perovskita es el nombre genérico para los óxidos con dos tipos diferentes de metal y tienen la fórmula general MM′O 3, como CaTiO 3. La estructura es una matriz cúbica centrada en el cuerpo (bcc) de dos iones metálicos, con un M (Ca en este caso) ubicado en las esquinas del cubo, y el otro M′ (en este caso Ti) en los centros del cubo. Los óxidos se encuentran en los centros de las caras cuadradas (parte (a) en la Figura 12.12). La estequiometría predicha a partir de la celda unitaria mostrada en la parte (a) en la Figura 12.12 concuerda con la fórmula general; cada celda unitaria contiene 8×\({1 \over 8}\) =1 Ca, 1 Ti y 6×\({1 \over 2} \) =3 átomos de O. Los átomos de Ti y Ca tienen números de coordinación de 6 y 12, respectivamente. Volveremos a la estructura de perovskita cuando discutamos los superconductores de alta temperatura en la Sección 12.7.

Figura 12.12 La estructura de la perovskita del CaTiO 3. Se muestran dos vistas equivalentes: (a) una vista con el átomo de Ti en el centro y (b) una vista alternativa con el átomo de Ca en el centro.
Difracción de rayos X
Como aprendiste en el Capítulo 6, las longitudes de onda de los rayos X son aproximadamente de la misma magnitud que las distancias entre átomos en moléculas o iones. En consecuencia, los rayos X son una herramienta útil para obtener información sobre las estructuras de las sustancias cristalinas. En una técnica llamada difracción de rayos X, un haz de rayos X se dirige a una muestra de un material cristalino, y los rayos X son difractados por capas de átomos en la red cristalina (parte (a) en la Figura 12.13). Cuando el haz choca con película fotográfica, produce un patrón de difracción de rayos X, el cual consiste en manchas oscuras sobre un fondo claro (parte (b) en la Figura 12.13). En 1912, el físico alemán Max von Laue (1879—1960; Premio Nobel de Física, 1914) predijo que los rayos X deberían ser difractados por cristales, y su predicción se confirmó rápidamente. Dentro de un año, dos físicos británicos, William Henry Bragg (1862-1942) y su hijo, William Lawrence Bragg (1890—1972), habían elaborado las matemáticas que permiten que la difracción de rayos X se utilice para medir distancias interatómicas en cristales. Los Braggs compartieron el Premio Nobel de Física en 1915, cuando el hijo solo tenía 25 años. Prácticamente todo lo que conocemos hoy sobre las estructuras detalladas de sólidos y moléculas en sólidos se debe a la técnica de difracción de rayos X.
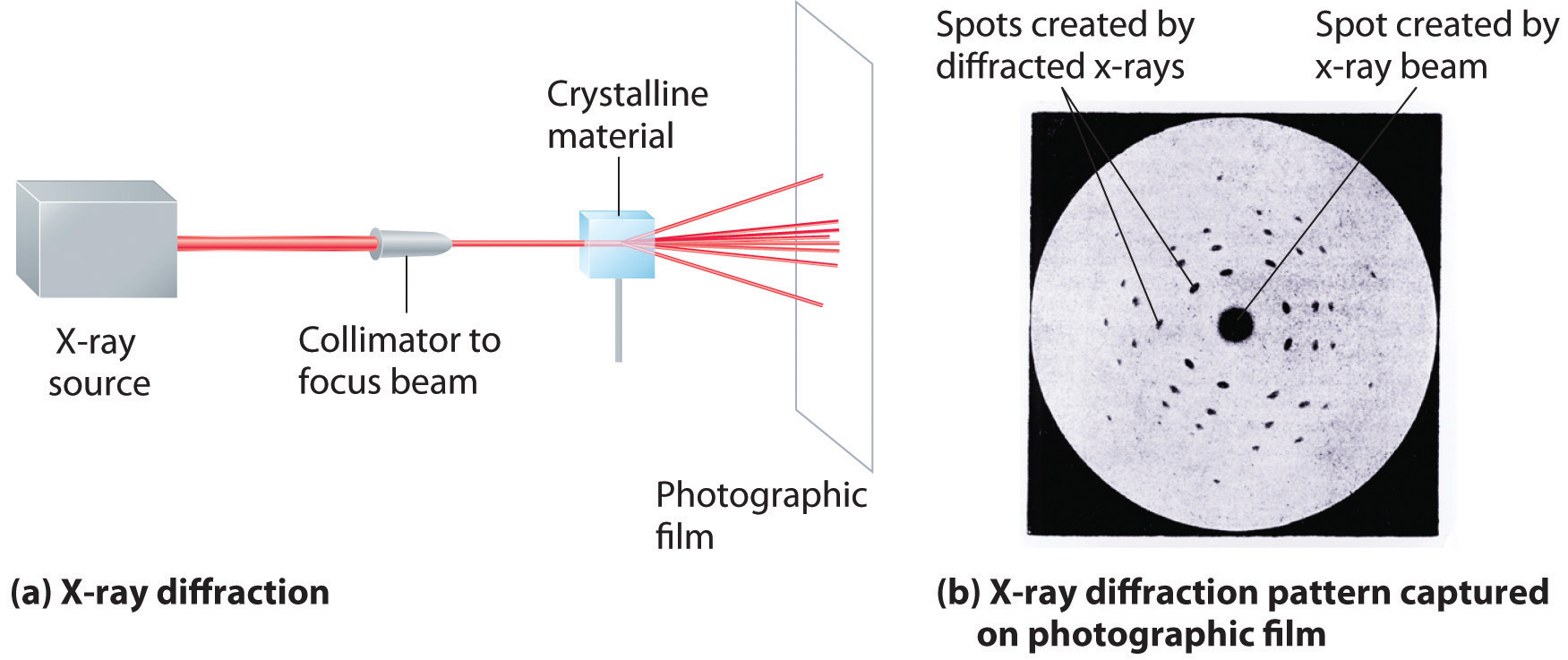
Figura 12.13 Difracción de Rayos X. Estas ilustraciones muestran (a) un dibujo esquemático de difracción de rayos X y (b) el patrón de difracción de rayos X de un sólido cristalino de blenda de zinc capturado en película fotográfica.
Recordemos del Capítulo 6 que dos ondas que están en fase interfieren constructivamente, reforzándose así entre sí y generando una onda con mayor amplitud. En contraste, dos ondas que están desfasadas interfieren destructivamente, cancelándose efectivamente entre sí. Cuando los rayos X interactúan con los componentes de una red cristalina, son dispersados por las nubes de electrones asociadas a cada átomo. Como se muestra en la Figura 12.5, Figura 12.7 y Figura 12.8, los átomos en los sólidos cristalinos se disponen típicamente en planos. La Figura 12.14 ilustra cómo dos planos adyacentes de átomos pueden dispersar los rayos X de una manera que resulta en interferencia constructiva. Si dos rayos X que están inicialmente en fase son difractados por dos planos de átomos separados por una distancia d, el haz inferior recorre la distancia extra indicada por las líneas BC y CD. El ángulo de incidencia, designado como θ, es el ángulo entre el haz de rayos X y los planos en el cristal. Debido a que BC = CD = d sin θ, la distancia extra que debe recorrer la viga inferior en la Figura 12.14 en comparación con la viga superior es 2d sin θ. Para que estos dos rayos X lleguen a un detector en fase, la distancia extra recorrida debe ser un múltiplo integral n de la longitud de onda λ:
\[2d \sin \theta = n\lambda \tag{12.1}\]
La ecuación 12.1 es la ecuación de Bragg. Las estructuras de sustancias cristalinas con moléculas pequeñas e iones o moléculas biológicas muy grandes, con masas moleculares superiores a 100,000 amu, ahora se pueden determinar de manera precisa y rutinaria usando difracción de rayos X y la ecuación de Bragg. El Ejemplo 4 ilustra cómo usar la ecuación de Bragg para calcular la distancia entre planos de átomos en cristales.

Figura 12.14 La reflexión de los rayos X de dos planos adyacentes de átomos puede resultar en interferencia constructiva de los rayos X. (a) Los rayos X difractados por la capa inferior de átomos deben recorrer una distancia que sea mayor en 2d sin θ que la distancia recorrida por los rayos X difractados por la capa superior de átomos. Solo si esta distancia (BC más CD) es igual a un número integral de longitudes de onda de los rayos X (es decir, solo si λ = 2d sin θ) los rayos X llegarán al detector en fase. (b) En un sólido, muchos conjuntos diferentes de planos de átomos pueden difractar los rayos X. Cada uno tiene una distancia interplanar diferente y por lo tanto difracta los rayos X en un ángulo θ diferente, lo que produce un patrón característico de manchas.
| Ejemplo 4 |
|---|
|
Rayos X de un tubo de rayos X de cobre (λ = 1.54062 Å o 154.062pm) En la difracción de rayos X, los angstrom (Å) se utilizan generalmente como unidad de longitud de onda. Se difractan en un ángulo de 10.89° a partir de una muestra de oro cristalino. Suponiendo que n = 1, ¿cuál es la distancia entre los planos que da lugar a esta reflexión? Da tu respuesta en angstroms y picometros a cuatro cifras significativas. Dado: longitud de onda, ángulo de difracción y número de longitudes de onda Preguntado por: distancia entre aviones Estrategia: Sustituir los valores dados en la ecuación de Bragg y resolver para obtener la distancia entre planos. Solución: Se nos da n, θ y λ y se nos pide que resolvamos para d, por lo que esta es una aplicación sencilla de la ecuación de Bragg. Para una respuesta en angstroms, ni siquiera tenemos que convertir unidades. Resolviendo la ecuación de Bragg para d da \[ d = {n \lambda \over 2 \sin \theta } \] y sustituyendo valores da\[ d = {(1) (1.54062 \, \overset {0}{A} ) \over 2 \, sin \, 10.89^0 } = 4.077 \, \overset {0}{A} = 407.7 \, pm \] Este valor corresponde a la longitud del borde de la celda unitaria fcc de oro elemental.Ejercicio Los rayos X de un tubo de rayos X de molibdeno (λ = 0.709300 Å) se difractan en un ángulo de 7.11° de una muestra de hierro metálico. Suponiendo que n = 1, ¿cuál es la distancia entre los planos que da lugar a esta reflexión? Da tu respuesta en angstroms y picometros a tres cifras significativas. Respuesta: 2.87 Å o 287pm (correspondiente a la longitud del borde de la celda unitaria bcc de hierro elemental) |
Resumen
Las estructuras de la mayoría de los compuestos binarios están dictadas por la disposición de empaquetamiento de las especies más grandes presentes (los aniones), con las especies más pequeñas (los cationes) ocupando agujeros de tamaño apropiado en la red aniónica. Una simple celosía cúbica de aniones contiene un solo orificio cúbico en el centro de la celda unitaria. La colocación de un catión en el agujero cúbico da como resultado la estructura de cloruro de cesio, con una relación 1:1 catión:anión y un número de coordinación de 8 tanto para el catión como para el anión. Una matriz fcc de átomos o iones contiene agujeros octaédricos y agujeros tetraédricos. Si los agujeros octaédricos en una red fcc de aniones están llenos de cationes, el resultado es una estructura de cloruro de sodio. También tiene una relación 1:1 catión:anión, y cada ion tiene un número de coordinación de 6. La ocupación de la mitad de los agujeros tetraédricos por cationes da como resultado la estructura de la blenda de zinc, con una relación catión:anión 1:1 y un número de coordinación de 4 para los cationes. Estructuras más complejas son posibles si hay más de dos tipos de átomos en un sólido. Un ejemplo es la estructura de perovskita, en la que los dos iones metálicos forman una matriz alterna de bcc con los aniones en los centros de las caras cuadradas. Debido a que la longitud de onda de la radiación de rayos X es comparable a las distancias interatómicas en la mayoría de los sólidos, la difracción de rayos X se puede utilizar para proporcionar información sobre las estructuras de Los rayos X difractados de diferentes planos de átomos en un sólido se refuerzan mutuamente si están en fase, lo que ocurre solo si la distancia extra que recorren corresponde a un número integral de longitudes de onda. Esta relación es descrita por la ecuación de Bragg: 2d sin θ = nλ.
Llave para llevar
- La relación de cationes a aniones dentro de una celda unitaria produce neutralidad eléctrica y corresponde a la estequiometría masiva de un compuesto, cuya estructura se puede determinar mediante difracción de rayos X.
Ecuación Clave
Ecuación de Bragg
\[2d \sin \theta = n\lambda \tag{12.1}\]
Problemas conceptuales
1. Usando círculos o esferas, dibuje una celda unitaria que contenga un agujero octaédrico. ¿Cuál de los tipos estructurales básicos posee agujeros octaédricos? Si se colocara un ión en un agujero octaédrico, ¿cuál sería su número de coordinación?
2. Usando círculos o esferas, dibuje una celda unitaria que contenga un agujero tetraédrico. ¿Cuál de los tipos estructurales básicos posee agujeros tetraédricos? Si se colocara un ión en un agujero tetraédrico, ¿cuál sería su número de coordinación?
3. ¿Cuántos agujeros octaédricos hay en cada celda unitaria de la estructura de cloruro de sodio? El fluoruro de potasio contiene una red fcc de iones F − que es idéntica a la disposición de los iones Cl − en la estructura del cloruro de sodio. ¿Espera que los iones K + ocupen los agujeros tetraédricos u octaédricos en la red fcc de los iones F −?
4. La celda unitaria de cloruro de cesio consiste en una matriz cúbica de iones cloruro con un ion de cesio en el centro. ¿Por qué entonces se describe que el cloruro de cesio tiene una estructura cúbica simple en lugar de una estructura bcc? La celda unitaria de hierro también consiste en una matriz cúbica de átomos de hierro con un átomo de hierro en el centro del cubo. ¿Es esto un bcc o una celda unitaria cúbica simple? Explica tu respuesta.
5. ¿Por qué se utilizan rayos X para determinar la estructura de los materiales cristalinos? ¿Podrían utilizarse también los rayos gamma para determinar las estructuras cristalinas? ¿Por qué o por qué no?
6. Los rayos X son más altos en energía que la mayoría de las otras formas de radiación electromagnética, incluida la luz visible. ¿Por qué no se puede utilizar la luz visible para determinar la estructura de un material cristalino?
7. Cuando los rayos X interactúan con los átomos en una red cristalina, ¿qué relación entre las distancias entre los planos de los átomos en la estructura cristalina y la longitud de onda de los rayos X da como resultado que los rayos X dispersos estén exactamente en fase entre sí? ¿Qué diferencia de estructura entre los materiales amorfos y los materiales cristalinos dificulta determinar las estructuras de los materiales amorfos por difracción de rayos X?
8. Es posible utilizar diferentes fuentes de rayos X para generar rayos X con diferentes longitudes de onda. Utilice la ecuación de Bragg para predecir cómo cambiaría el ángulo de difracción si se utilizara una fuente de rayos X de molibdeno (longitud de onda de rayos X = 70.93 pm) en lugar de una fuente de cobre (longitud de onda de rayos X = 154.1
9. Con base en la ecuación de Bragg, si el cristal A tiene mayor espaciamiento en su patrón de difracción que el cristal B, ¿qué conclusión se puede sacar sobre el espaciamiento entre capas de átomos en A en comparación con B?
Problemas numéricos
1. El bromuro de talio cristaliza en la estructura del cloruro de cesio. Esta estructura bcc contiene un ion Tl+ en el centro del cubo con iones Br − en las esquinas. Esboce una celda unitaria alternativa para este compuesto.
2. El fluoruro de potasio tiene una red idéntica a la del cloruro de sodio. Los iones potasio ocupan agujeros octaédricos en una red fcc de iones fluoruro. Proponer una celda unitaria alternativa que también pueda representar la estructura de KF.
3. El fluoruro de calcio se utiliza para fluorurar el agua potable para promover la salud dental. El CaF 2 cristalino (d = 3.1805 g/cm 3) tiene una estructura en la que se localizan iones de calcio en cada esquina y en el centro de cada borde de la celda unitaria, la cual contiene ocho iones fluoruro por celda unitaria. La longitud del borde de esta celda unitaria es de 5.463 Å. Usa esta información para determinar el número de Avogadro.
4. El zinc y el oxígeno forman un compuesto que se utiliza tanto como semiconductor como pigmento de pintura. Este compuesto tiene la siguiente estructura:

¿Cuál es la fórmula empírica de este compuesto?
5. Aquí hay dos representaciones de la estructura de la perovskita:

¿Son idénticos? ¿Cuál es la fórmula empírica correspondiente a cada representación?
6. La sal MX 2 tiene una estructura cúbica de empaquetamiento cerrado (ccp) en la que todos los agujeros tetraédricos están llenos de aniones. ¿Cuál es el número de coordinación de M? de X?
7. Un compuesto tiene una estructura basada en el simple empaque cúbico de los aniones, y los cationes ocupan la mitad de los agujeros cúbicos. ¿Cuál es la fórmula empírica de este compuesto? ¿Cuál es el número de coordinación del catión?
8. El bario y el fluoruro forman un compuesto que cristaliza en la estructura de fluorita, en la que los iones fluoruro ocupan todos los orificios tetraédricos en una matriz ccp de iones de bario. Este compuesto particular se utiliza en el fluido de embalsamamiento. ¿Cuál es su fórmula empírica?
9. El cloruro de cadmio se utiliza en pinturas como pigmento amarillo. ¿La siguiente estructura es consistente con una fórmula empírica de CDCl 2? Si no, ¿cuál es la fórmula empírica de la estructura mostrada?

10. Utilice la información de la siguiente tabla para decidir si el catión ocupará un agujero tetraédrico, un agujero octaédrico o un agujero cúbico en cada caso.
| Radio de cationes (pm) | Radio del anión (pm) |
|---|---|
| 78.0 | 132 |
| 165 | 133 |
| 81 | 174 |
11. Calcular el ángulo de difracción cuando los rayos X de un tubo de cobre (λ = 154pm) son difractados por planos de átomos paralelos a las caras de la celda unitaria cúbica para Mg (260pm), Zn (247pm) y Ni (216pm). La longitud en un borde de la celda unitaria se da entre paréntesis; supongamos difracción de primer orden (n = 1).
12. Si los rayos X de un objetivo de cobre (λ = 154pm) son dispersados en un ángulo de 17.23° por una muestra de Mg, ¿cuál es la distancia (en picometros) entre los planos responsables de esta difracción? ¿Cómo se compara esta distancia con la de una muestra de Ni para la cual θ = 20.88°?
Respuestas numéricas
3. d = 3.1805 g/cm 3; Número de Avogadro = 6.023 × 10 23 mol −1
5. Ambos tienen la misma estequiometría, CaTiO 3
7. La estequiometría es MX 2; el número de coordinación de cationes es 8
9. No, la estructura mostrada tiene una fórmula empírica de Cd 3 Cl 8.
11. Mg: 17.2°, Zn: 18.2°, Ni: 20.9°


