12.6: Metales y Semiconductores
- Page ID
- 78040
- Describir las propiedades eléctricas de un sólido usando la teoría de bandas.
Para explicar las propiedades observadas de los metales, se necesita un enfoque más sofisticado que el modelo electrón-mar descrito en la Sección 12.5. La teoría orbital molecular que usamos en la Sección 6.5 para explicar el enlace π deslocalizado en iones poliatómicos y moléculas como NO 2 −, ozono y 1,3-butadieno pueden adaptarse para acomodar el número mucho mayor de orbitales atómicos que interactúan entre sí simultáneamente en metales.
Teoría de Bandas
En una muestra de 1 mol de un metal, puede haber más de 10 interacciones orbitales 24 a considerar. En nuestra descripción orbital molecular de los metales, sin embargo, comenzamos por considerar un simple ejemplo unidimensional: una disposición lineal de n átomos metálicos, cada uno conteniendo un solo electrón en un orbital s. Utilizamos este ejemplo para describir una aproximación a la unión metálica llamada teoría de bandas Una teoría utilizada para describir la unión en metales y semiconductores. , que asume que los orbitales de valencia de los átomos en un sólido interactúan, generando un conjunto de orbitales moleculares que se extienden por todo el sólido.
Sistemas unidimensionales
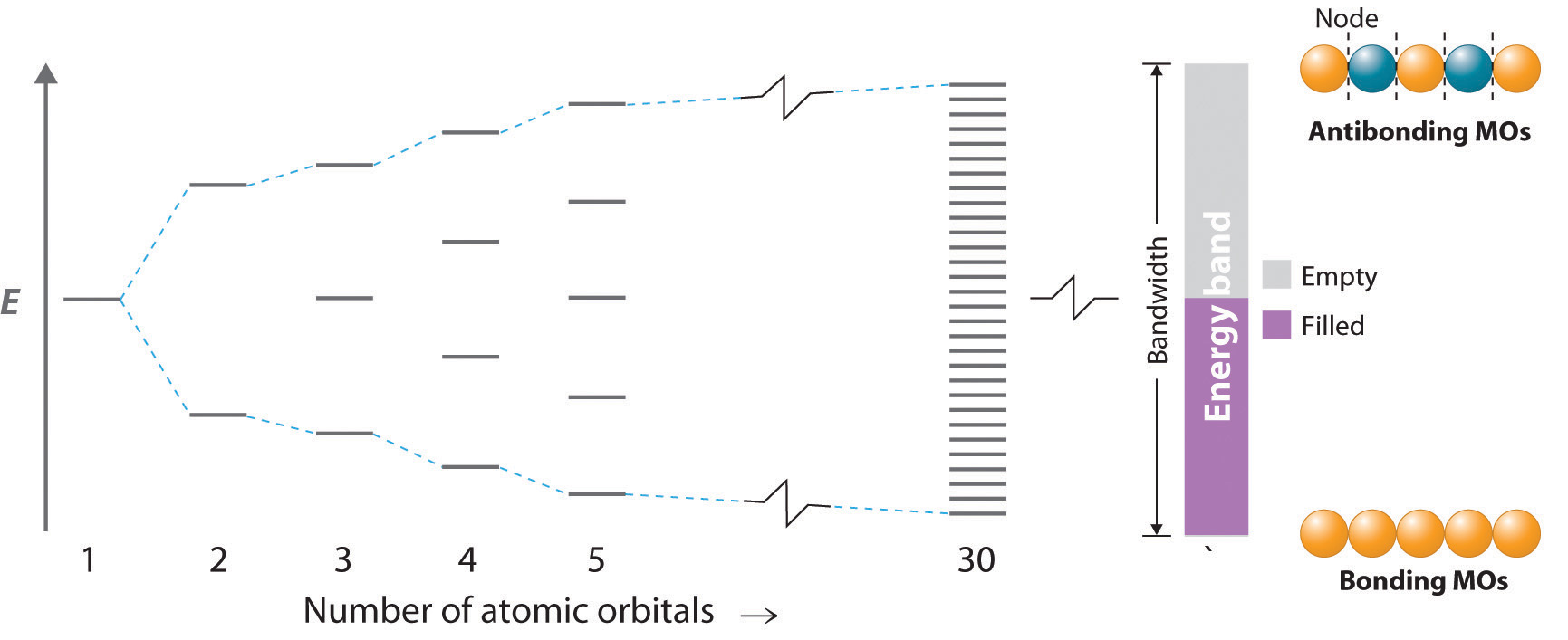
Si la distancia entre los átomos metálicos es lo suficientemente corta para que los orbitales interactúen, producen orbitales moleculares enlazantes, antiadherentes y no enlazantes. La porción izquierda de la Figura 12.6.1 muestra el patrón de orbitales moleculares que resulta de la interacción de ns orbitales a medida que n aumenta de 2 a 5.
Figura 12.6.1 El diagrama de nivel de energía orbital molecular para una disposición lineal de n átomos, cada uno de los cuales contiene un orbital s solo ocupado La porción extrema derecha, correspondiente a n = 30 y n = ∞. A medida que n se vuelve muy grande, la separación de energía entre niveles adyacentes se vuelve tan pequeña que resulta una sola banda continua de niveles de energía permitidos. El orbital molecular de menor energía corresponde a un solapamiento positivo entre todos los orbitales atómicos para dar una combinación totalmente enlazante, mientras que el orbital molecular de mayor energía contiene un nodo entre cada par de átomos y, por lo tanto, es totalmente antienlace.
Como vimos en el Capítulo 6, el orbital de menor energía es el orbital molecular completamente unido, mientras que el orbital de mayor energía es el orbital molecular completamente antiadherentes. Los orbitales moleculares de energía intermedia tienen menos nodos que los orbitales moleculares totalmente antiadherentes. La separación de energía entre orbitales adyacentes disminuye a medida que aumenta el número de orbitales que interactúan. Para n = 30, todavía hay niveles de energía discretos y bien resueltos, pero a medida que n aumenta de 30 a un número cercano al número de Avogadro, el espaciamiento entre los niveles de energía adyacentes se vuelve casi infinitamente pequeño. El resultado es esencialmente un continuo de niveles de energía, como se muestra a la derecha en la Figura 12.6.1, cada uno de los cuales corresponde a un orbital molecular particular que se extiende a lo largo de la matriz lineal de átomos metálicos. Los niveles que son más bajos en energía corresponden principalmente a combinaciones de enlaces de orbitales atómicos, los más altos en energía corresponden principalmente a combinaciones antiadherentes, y los del medio corresponden a combinaciones esencialmente no enlazantes.
El conjunto continuo de niveles de energía permitidos que se muestra a la derecha en la Figura 12.6.1 se denomina banda de energía El conjunto continuo de niveles de energía permitidos generados en la teoría de bandas cuando los orbitales de valencia de los átomos en un sólido interactúan entre sí, creando así un conjunto de orbitales moleculares que se extienden por todo el sólido. . La diferencia de energía entre los niveles de energía más altos y más bajos es el ancho de banda La diferencia en energía entre los niveles de energía más altos y más bajos en una banda de energía. y es proporcional a la fuerza de la interacción entre orbitales en átomos adyacentes: cuanto más fuerte es la interacción, mayor es el ancho de banda. Debido a que la banda contiene tantos niveles de energía como orbitales moleculares, y el número de orbitales moleculares es el mismo que el número de orbitales atómicos que interactúan, la banda en la Figura 12.6.1 contiene n niveles de energía correspondientes a la combinación de orbitales s de n átomos de metal. Cada uno de los orbitales s originales podría contener un máximo de dos electrones, por lo que la banda puede acomodar un total de 2 n electrones. Recordemos, sin embargo, que cada uno de los átomos metálicos con los que comenzamos contenía solo un solo electrón en cada s orbital, por lo que solo hay n electrones para colocar en la banda. Al igual que con los orbitales atómicos u orbitales moleculares, los electrones ocupan los niveles de energía más bajos disponibles. En consecuencia, sólo se llena la mitad inferior de la banda. Esto corresponde a llenar todos los orbitales moleculares de enlace en la matriz lineal de átomos metálicos y resulta en el enlace más fuerte posible.
Sistemas Multidimensionales
El ejemplo anterior fue una matriz unidimensional de átomos que solo tenía orbitales s. Extrapolar a sistemas bidimensionales o tridimensionales y átomos con electrones en orbitales p y d es sencillo en principio, aunque en la práctica las matemáticas se vuelven más complejas, y los orbitales moleculares resultantes son más difíciles de visualizar. Los diagramas de nivel de energía resultantes son esencialmente los mismos que el diagrama del ejemplo unidimensional de la Figura 12.6.1, con la siguiente excepción: contienen tantas bandas como diferentes tipos de orbitales interactuantes. Debido a que diferentes orbitales atómicos interactúan de manera diferente, cada banda tendrá un ancho de banda diferente y se centrará en una energía diferente, correspondiente a la energía del orbital atómico padre de un átomo aislado.
Banda Gap
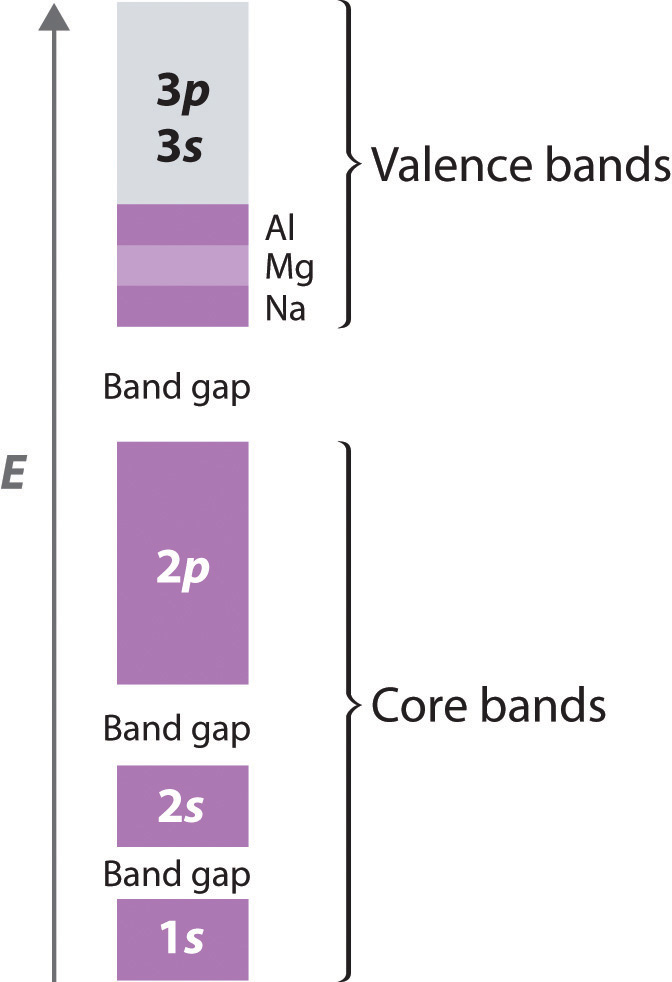
Debido a que los orbitales 1 s, 2 s y 2 p de un átomo de período 3 son niveles centrales llenos, no interactúan fuertemente con los orbitales correspondientes en átomos adyacentes. De ahí que formen bandas bastante estrechas que están bien separadas en energía (Figura 12.6.2). Estas bandas están completamente rellenas (tanto los niveles de unión como de antiadhesión están completamente poblados), por lo que no hacen una contribución neta a la unión en el sólido. La diferencia de energía entre el nivel más alto de una banda y el nivel más bajo de la siguiente es la brecha de banda La diferencia de energía entre el nivel más alto de una banda de energía y el nivel más bajo de la banda por encima de ella, lo que representa un conjunto de energías prohibidas que no corresponden a cualquier combinación permitida de orbitales atómicos. . Representa un conjunto de energías prohibidas que no corresponden a ninguna combinación permitida de orbitales atómicos.
Figura 12.6.2 Las Estructuras de Banda del Periodo 3 Metales Na, Mg y Al Las bandas de valencia de 3 s y 3 p se superponen en energía para formar un conjunto continuo de niveles de energía que pueden contener un máximo de ocho electrones por átomo.
Debido a que se extienden más lejos del núcleo, los orbitales de valencia de los átomos adyacentes (3 s y 3 p en la Figura 12.6.2) interactúan mucho más fuertemente entre sí que los niveles del núcleo relleno; como resultado, las bandas de valencia tienen un ancho de banda mayor. De hecho, las bandas derivadas de los orbitales atómicos de 3 s y 3 p son más anchas que la brecha de energía entre ellos, por lo que el resultado son bandas superpuestas Orbitales moleculares derivados de dos o más tipos diferentes de electrones de valencia que tienen energías similares. . Estos tienen orbitales moleculares derivados de dos o más orbitales de valencia con energías similares. Como la banda de valencia se llena con uno, dos o tres electrones por átomo para Na, Mg y Al, respectivamente, la banda combinada que surge del solapamiento de las bandas de 3 s y 3 p también se está llenando; tiene una capacidad total de ocho electrones por átomo (dos electrones por cada 3 s orbital y seis electrones por cada conjunto de orbitales de 3 p). Con Na, por lo tanto, que tiene un electrón de valencia, la banda de valencia combinada está llena de un octavo; con Mg (dos electrones de valencia), está llena de un cuarto; y con Al, está llena de tres octavos, como se indica en la Figura 12.6.2. La banda de valencia parcialmente llena es absolutamente crucial para explicar el comportamiento metálico porque garantiza que hay niveles de energía desocupada a una energía infinitesimalmente pequeña por encima del nivel ocupado más alto.
La teoría de bandas puede explicar prácticamente todas las propiedades de los metales. Los metales conducen la electricidad, por ejemplo, porque solo se requiere una cantidad muy pequeña de energía para excitar un electrón de un nivel lleno a uno vacío, donde es libre de migrar rápidamente por todo el cristal en respuesta a un campo eléctrico aplicado. De igual manera, los metales tienen altas capacidades caloríficas (como sin duda recuerdas de la última vez que un médico o una enfermera le colocaron un estetoscopio en la piel) porque los electrones en la banda de valencia pueden absorber energía térmica al ser excitados a los niveles bajos de energía vacía. Finalmente, los metales son lustrosos porque la luz de varias longitudes de onda puede ser absorbida, haciendo que los electrones de valencia sean excitados en cualquiera de los niveles de energía vacíos por encima del nivel ocupado más alto. Cuando los electrones decaen de nuevo a niveles vacíos bajos, emiten luz de diferentes longitudes de onda. Debido a que los electrones pueden excitarse a partir de muchos niveles de relleno diferentes en un sólido metálico y luego pueden decaer de nuevo a cualquiera de los muchos niveles vacíos, la luz de longitudes de onda variables es absorbida y reemitida, lo que da como resultado la apariencia brillante característica que asociamos con los metales.
Requisitos para el Comportamiento Metálico
Para que un sólido exhiba un comportamiento metálico, debe tener un conjunto de orbitales deslocalizados formando una banda de niveles de energía permitidos, y la banda resultante debe estar solo parcialmente llena (10% — 90%) con electrones. Sin un conjunto de orbitales deslocalizados, no hay vía por la cual los electrones puedan moverse a través del sólido.
Tenga en cuenta el patrón
El comportamiento metálico requiere un conjunto de orbitales deslocalizados y una banda de niveles de energía permitidos que está parcialmente ocupada.
La teoría de bandas explica la correlación entre la configuración electrónica de valencia de un metal y la resistencia de la unión metálica. Los electrones de valencia de los metales de transición ocupan sus orbitales de valencia ns, (n − 1) d y np (con una capacidad total de 18 electrones por átomo de metal) o sus orbitales ns y (n − 1) d (una capacidad total de 12 electrones por átomo de metal). Estos orbitales atómicos están lo suficientemente cerca en energía como para que las bandas derivadas se superpongan, por lo que los electrones de valencia no están confinados a un orbital específico. Los metales con 6 a 9 electrones de valencia (que corresponden a los grupos 6—9) son los que tienen más probabilidades de llenar las bandas de valencia aproximadamente a la mitad. Por lo tanto, esos electrones ocupan el mayor número posible de niveles de unión, mientras que el número de niveles antiadherentes ocupados es mínimo. No casualmente, los elementos de estos grupos presentan propiedades físicas consistentes con la presencia de la unión metálica más fuerte, como puntos de fusión muy altos.
Aisladores
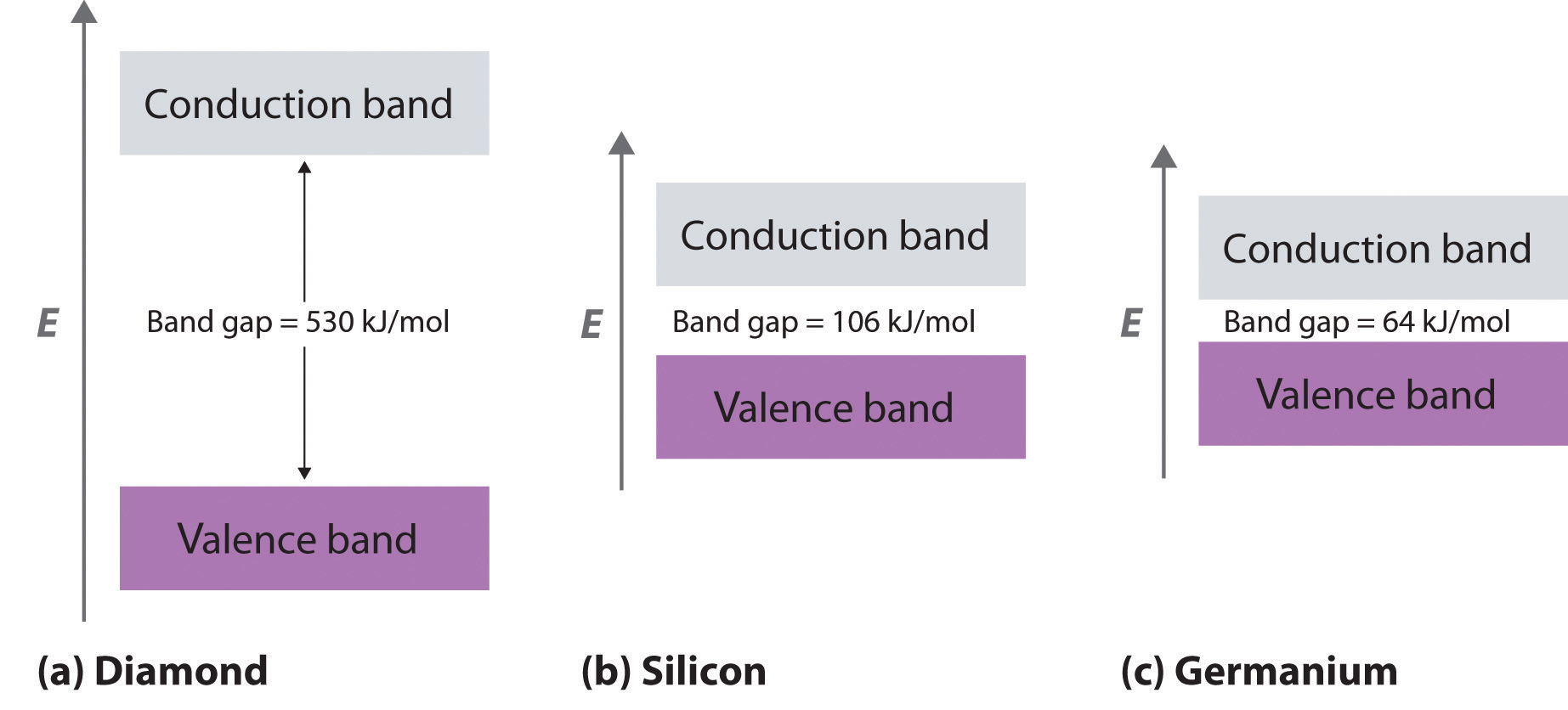
A diferencia de los metales, aislantes eléctricos Un material que conduce la electricidad mal porque sus bandas de valencia están llenas. son materiales que conducen mal la electricidad porque sus bandas de valencia están llenas. La brecha de energía entre los niveles llenos más altos y los niveles de vacío más bajos es tan grande que los niveles vacíos son inaccesibles: la energía térmica no puede excitar un electrón de un nivel lleno a uno vacío. La estructura de banda de valencia del diamante, por ejemplo, se muestra en la parte (a) en la Figura 12.6.3. Debido a que el diamante tiene solo 4 vecinos unidos en lugar de los 6 a 12 típicos de los metales, los orbitales de carbono 2 s y 2 p se combinan para formar dos bandas en el sólido, representando la de menor energía los orbitales moleculares de unión y la de mayor energía representando el antienlace orbitales moleculares. Cada banda puede acomodar cuatro electrones por átomo, por lo que solo se ocupa la banda inferior. Debido a que la brecha de energía entre la banda llena y la banda vacía es muy grande (530 kJ/mol), a temperaturas normales la energía térmica no puede excitar electrones del nivel lleno a la banda vacía. Por lo tanto, no existe una vía por la cual los electrones puedan moverse a través del sólido, por lo que el diamante tiene una de las conductividades eléctricas más bajas conocidas.
Semiconductores
¿Y si la diferencia de energía entre el nivel ocupado más alto y el nivel de vacío más bajo es intermedia entre los de conductores eléctricos y aisladores? Este es el caso del silicio y el germanio, que tienen la misma estructura que el diamante. Debido a que los enlaces Si—Si y Ge-Ge son sustancialmente más débiles que los enlaces C-C, la brecha de energía entre las bandas llena y vacía se vuelve mucho menor a medida que bajamos del grupo 14 (parte (b) y parte (c) de la Figura 12.6.3"). (Para obtener más información sobre las resistencias de unión, consulte la Sección 5.5.) En consecuencia, la energía térmica es capaz de excitar un pequeño número de electrones de la banda de valencia llena de Si y Ge hacia la banda vacía por encima de ella, que se llama la banda de conducción La banda de orbitales moleculares vacíos en un semiconductor. .
La excitación de los electrones desde la banda de valencia llena hasta la banda de conducción vacía provoca un aumento en la conductividad eléctrica por dos razones:
- Los electrones en la banda de conducción previamente vacante son libres de migrar a través del cristal en respuesta a un campo eléctrico aplicado.
- La excitación de un electrón de la banda de valencia produce un “agujero” en la banda de valencia que es equivalente a una carga positiva. El agujero en la banda de valencia puede migrar a través del cristal en dirección opuesta a la del electrón en la banda de conducción mediante un mecanismo de “brigada de cubeta” en el que un electrón adyacente llena el agujero, generando así un agujero donde había estado el segundo electrón, y así sucesivamente.
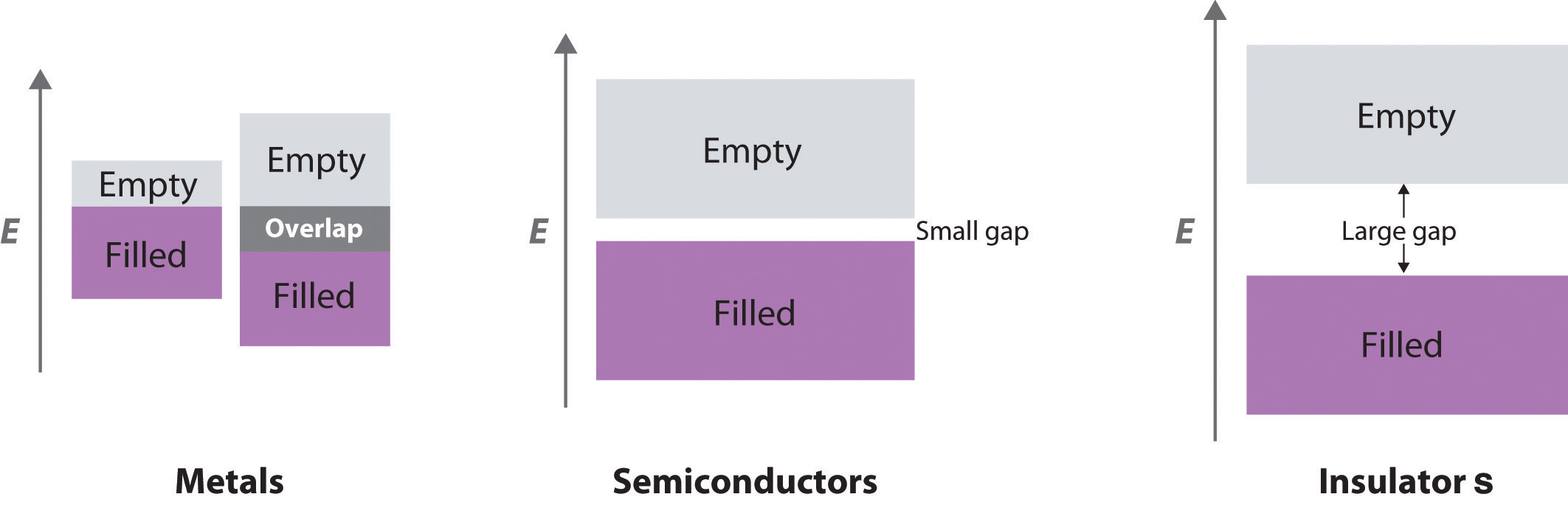
En consecuencia, Si es un conductor eléctrico mucho mejor que el diamante, y Ge es aún mejor, aunque ambos siguen siendo conductores mucho más pobres que un metal típico (Figura 12.6.4). Sustancias como Si y Ge que tienen conductividades entre las de metales y aislantes se denominan semiconductores Una sustancia como Si y Ge que tiene una conductividad entre la de los metales y los aislantes. . Muchos compuestos binarios de los elementos del grupo principal presentan un comportamiento semiconductor similar al de Si y Ge. Por ejemplo, el arseniuro de galio (GaAs) es isoelectrónico con Ge y tiene la misma estructura cristalina, con átomos alternantes de Ga y As; no en vano, también es un semiconductor. La estructura electrónica de los semiconductores se compara con las estructuras de metales y aislantes en la Figura 12.6.5.
Figura 12.6.4 Una escala logarítmica que ilustra el enorme rango de conductividades eléctricas de sólidos
Figura 12.6.5 Una comparación de las características clave de las estructuras de banda de metales, semiconductores y aisladoresEl comportamiento metálico puede surgir de la presencia de una sola banda parcialmente llena o de dos bandas superpuestas (una llena y otra vacía).
Temperatura y Conductividad
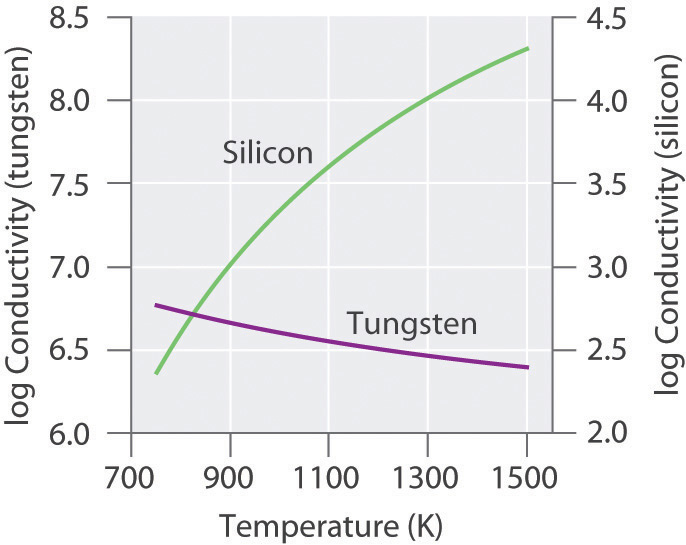
Debido a que la energía térmica puede excitar electrones a través de la banda prohibida en un semiconductor, aumentar la temperatura aumenta el número de electrones que tienen suficiente energía cinética para ser promovidos a la banda de conducción. Por lo tanto, la conductividad eléctrica de un semiconductor aumenta rápidamente con el aumento de la temperatura, en contraste con el comportamiento de un cristal puramente metálico. En un metal, como un electrón viaja a través del cristal en respuesta a un potencial eléctrico aplicado, no puede viajar muy lejos antes de encontrarse y colisionar con un núcleo metálico. Cuanto más a menudo ocurren tales encuentros, más lento es el movimiento neto del electrón a través del cristal, y menor es la conductividad. A medida que aumenta la temperatura del sólido, los átomos metálicos en la red adquieren cada vez más energía cinética. Debido a que sus posiciones están fijas en la celosía, sin embargo, el aumento de la energía cinética aumenta solo en la medida en que vibran alrededor de sus posiciones fijas. A temperaturas más altas, por lo tanto, los núcleos metálicos chocan con los electrones móviles con mayor frecuencia y con mayor energía, disminuyendo así la conductividad. Este efecto es, sin embargo, sustancialmente menor que el aumento en la conductividad con la temperatura exhibida por los semiconductores. Por ejemplo, la conductividad de un alambre de tungsteno disminuye en un factor de solo aproximadamente dos en el rango de temperatura de 750—1500 K, mientras que la conductividad del silicio aumenta aproximadamente 100 veces en el mismo rango de temperatura. Estas tendencias se ilustran en la Figura 12.6.6.
Figura 12.6.6 La dependencia de la temperatura de la conductividad eléctrica de un metal frente a un semiconductor La conductividad del metal (tungsteno) disminuye relativamente lentamente con el aumento de la temperatura, mientras que la conductividad del semiconductor (silicio) aumenta mucho más rápidamente.
Tenga en cuenta el patrón
La conductividad eléctrica de un semiconductor aumenta con el aumento de la temperatura, mientras que la conductividad eléctrica de un metal disminuye con el aumento de la temperatura.
Semiconductores de tipo n y p
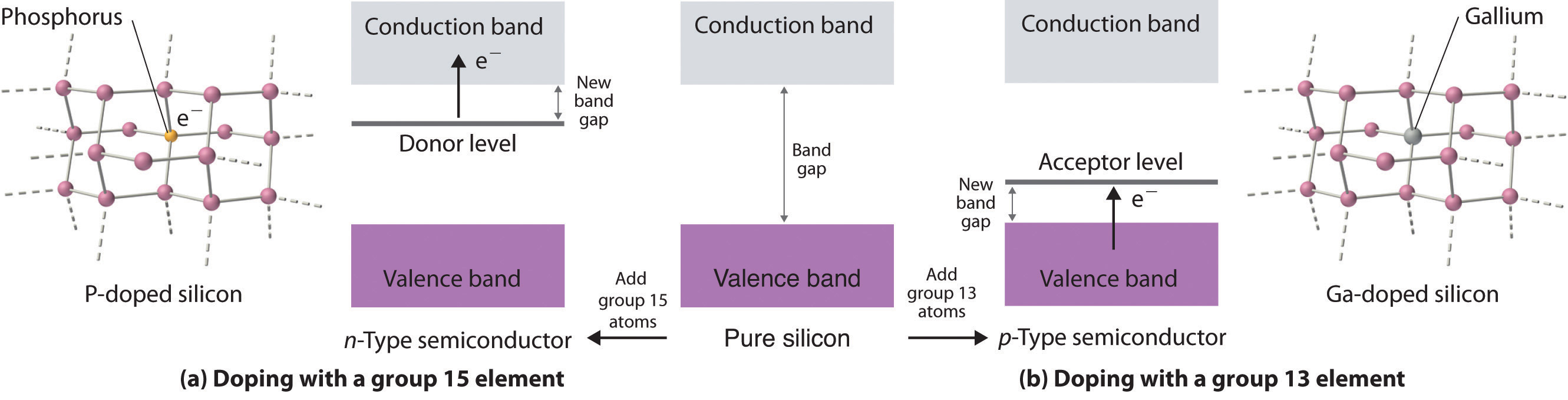
Dopaje El proceso de introducir deliberadamente pequeñas cantidades de impurezas en semiconductores comerciales para ajustar sus propiedades eléctricas para aplicaciones específicas. es un proceso utilizado para ajustar las propiedades eléctricas de los semiconductores comerciales mediante la introducción deliberada de pequeñas cantidades de impurezas. Si una impureza contiene más electrones de valencia que los átomos de la red huésped (por ejemplo, cuando pequeñas cantidades de un átomo del grupo 15 se introducen en un cristal de un elemento del grupo 14), entonces el sólido dopado tiene más electrones disponibles para conducir la corriente que el huésped puro tiene. Como se muestra en la parte (a) de la Figura 12.6.7, la adición de una impureza como fósforo a un cristal de silicio crea sitios ocasionales ricos en electrones en la red. La energía electrónica de estos sitios se encuentra entre las de la banda de valencia llena y la banda de conducción vacía pero más cerca de la banda de conducción. Debido a que los átomos que se introdujeron están rodeados por átomos del huésped, y los electrones asociados con la impureza son cercanos en energía a la banda de conducción, esos electrones adicionales se excitan con relativa facilidad en la banda de conducción vacía del huésped. Tal sustancia se llama semiconductor de tipo n Un semiconductor que ha sido dopado con una impureza que tiene más electrones de valencia que los átomos de la red huésped. , con el n indicando que los portadores de carga añadidos son negativos (son electrones).
Figura 12.6.7 Estructuras y diagramas de bandas de semiconductores de tipo n y tipo p (a) El dopaje de silicio con un elemento del grupo 15 da como resultado un nuevo nivel de relleno entre las bandas de valencia y conducción del huésped. b) El dopaje de silicio con un elemento del grupo 13 da como resultado un nuevo nivel de vacío entre las bandas de valencia y conducción del huésped. En ambos casos, la banda prohibida efectiva disminuye sustancialmente y la conductividad eléctrica a una temperatura dada aumenta drásticamente.
Si los átomos de impureza contienen menos electrones de valencia que los átomos del huésped (por ejemplo, cuando pequeñas cantidades de un átomo del grupo 13 se introducen en un cristal de un elemento del grupo 14), entonces el sólido dopado tiene menos electrones que el huésped puro. Quizás inesperadamente, esto también da como resultado un aumento de la conductividad debido a que los átomos de impurezas generan agujeros en la banda de valencia. Como se muestra en la parte (b) en la Figura 12.27, la adición de una impureza como el galio a un cristal de silicio crea sitios aislados deficientes en electrones en la red hospedadora. La energía electrónica de estos sitios vacíos también se encuentra entre los de la banda de valencia llena y la banda de conducción vacía del anfitrión pero mucho más cerca de la banda de valencia llena. Por lo tanto, es relativamente fácil excitar electrones de la banda de valencia del huésped a los átomos de impurezas aislados, formando así agujeros en la banda de valencia. Este tipo de sustancia se llama semiconductor tipo p Un semiconductor que ha sido dopado con una impureza que tiene menos electrones de valencia que los átomos de la red huésped. , con la p en pie para portador de carga positiva (es decir, un agujero). Los agujeros en lo que era una banda llena son tan efectivos como los electrones en una banda vacía para conducir electricidad.
Tenga en cuenta el patrón
Los semiconductores de tipo n son portadores de carga negativa; la impureza tiene más electrones de valencia que el huésped. Los semiconductores de tipo p son portadores de carga p ositiva; la impureza tiene menos electrones de valencia que el huésped.
La conductividad eléctrica de un semiconductor es aproximadamente proporcional al número de portadores de carga, por lo que el dopaje es una forma precisa de ajustar la conductividad de un semiconductor en un amplio rango. Toda la industria de semiconductores se construye sobre métodos para preparar muestras de Si, Ge o GaAs dopadas con cantidades precisas de impurezas deseadas y ensamblar chips de silicio y otros dispositivos complejos con uniones entre semiconductores de tipo n y p en diferentes números y disposiciones .
Debido a que el silicio no resiste bien temperaturas superiores a aproximadamente 100°C, los científicos se han interesado en desarrollar semiconductores hechos de diamantes, un material más estable térmicamente. Se ha desarrollado un nuevo método basado en la deposición de vapor, en el que se calienta una mezcla gaseosa a alta temperatura para producir carbono que luego se condensa sobre un grano de diamante. Este es el mismo método que ahora se utiliza para crear diamantes cultivados, los cuales son indistinguibles de los diamantes naturales. Los diamantes se calientan a más de 2000°C bajo alta presión para endurecerlos aún más. El dopado de los diamantes con boro ha producido semiconductores tipo p, mientras que el dopado con boro y deuterio logra un comportamiento tipo n. Debido a su estabilidad térmica, los semiconductores de diamante tienen usos potenciales como microprocesadores en aplicaciones de alto voltaje.
Ejemplo 12.6.1
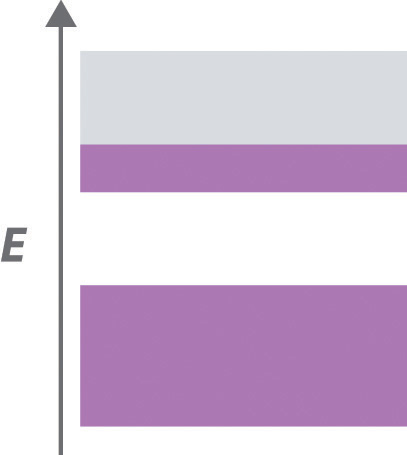
Un sólido cristalino tiene la siguiente estructura de bandas, con las áreas moradas representando regiones ocupadas por electrones. La banda inferior está completamente ocupada por electrones, y el nivel superior es de aproximadamente un tercio lleno de electrones.
- Predecir las propiedades eléctricas de este sólido.
- ¿Qué pasaría con las propiedades eléctricas si todos los electrones fueran retirados de la banda superior? ¿Usarías un oxidante o reductor químico para efectuar este cambio?
- ¿Qué pasaría con las propiedades eléctricas si se agregaran suficientes electrones para llenar completamente la banda superior? ¿Usarías un oxidante o reductor químico para efectuar este cambio?
Dado: estructura de banda
Preguntado por: variaciones en propiedades eléctricas con condiciones
Estrategia:
A Con base en la ocupación de las bandas inferior y superior, predecir si la sustancia será un conductor eléctrico. Entonces predice cómo cambiará su conductividad con la temperatura.
B Después de que se eliminen todos los electrones de la banda superior, predice cómo la banda gap afectaría las propiedades eléctricas del material. Determine si usaría un oxidante químico o reductor para eliminar electrones de la banda superior.
C Predecir el efecto de una banda superior rellena sobre las propiedades eléctricas del sólido. Entonces decide si usarías un oxidante o un reductor para llenar la banda superior.
Solución:
- A El material tiene una banda parcialmente llena, lo cual es crítico para el comportamiento metálico. Por lo tanto, el sólido se comportará como un metal, con alta conductividad eléctrica que disminuye ligeramente con el aumento de la temperatura.
- B Eliminar todos los electrones de la banda superior parcialmente llena crearía un sólido con una banda inferior llena y una banda superior vacía, separados por un espacio de energía. Si el espacio de banda es grande, el material será un aislante eléctrico. Si el hueco es relativamente pequeño, la sustancia será un semiconductor cuya conductividad eléctrica aumenta rápidamente al aumentar la temperatura. Eliminar los electrones requeriría un oxidante porque los oxidantes aceptan electrones.
- C Agregar suficientes electrones para llenar completamente la banda superior produciría un aislante eléctrico. Sin otra banda vacía relativamente cercana en energía por encima de la banda llena, el comportamiento de los semiconductores sería imposible. Agregar electrones al sólido requeriría un reductor porque los reductores son donantes de electrones.
Ejercicio
Una sustancia tiene la siguiente estructura de bandas, en la que la banda inferior está medio llena de electrones (área púrpura) y la banda superior está vacía.

- Predecir las propiedades eléctricas del sólido.
- ¿Qué pasaría con las propiedades eléctricas si todos los electrones fueran retirados de la banda inferior? ¿Usarías un oxidante o reductor químico para efectuar este cambio?
- ¿Qué pasaría con las propiedades eléctricas si se agregaran suficientes electrones para llenar completamente la banda inferior? ¿Usarías un oxidante o reductor químico para efectuar este cambio?
Contestar
- El sólido tiene una banda parcialmente llena, por lo que tiene las propiedades eléctricas de un conductor.
- Eliminar todos los electrones de la banda inferior produciría un aislante eléctrico con dos bandas vacías. Se requiere un oxidante.
- Agregar suficientes electrones para llenar completamente el nivel inferior daría como resultado un aislante eléctrico si el espacio de energía entre las bandas superior e inferior es relativamente grande, o un semiconductor si el espacio de banda es relativamente pequeño. Se requiere un reductor.
Resumen
La teoría de bandas asume que los orbitales de valencia de los átomos en un sólido interactúan para generar un conjunto de orbitales moleculares que se extienden por todo el sólido; el conjunto continuo de niveles de energía permitidos es una banda de energía. La diferencia de energía entre los niveles más altos y más bajos permitidos dentro de una banda dada es el ancho de banda, y la diferencia de energía entre el nivel más alto de una banda y el nivel más bajo de la banda por encima de ella es la brecha de banda. Si el ancho de las bandas adyacentes es mayor que el espacio de energía entre ellas, resultan bandas superpuestas, en las que los orbitales moleculares derivados de dos o más tipos de orbitales de valencia tienen energías similares. Las propiedades metálicas dependen de una banda parcialmente ocupada correspondiente a un conjunto de orbitales moleculares que se extienden a lo largo del sólido para formar una banda de niveles de energía. Si un sólido tiene una banda de valencia llena con una banda vacía relativamente baja por encima de ella (una banda de conducción), entonces los electrones pueden excitarse por energía térmica de la banda llena a la banda vacía donde luego pueden migrar a través del cristal, lo que resulta en conductividad eléctrica. Los aisladores eléctricos son conductores pobres porque sus bandas de valencia están llenas. Los semiconductores tienen conductividades eléctricas intermedias entre las de aisladores y metales. La conductividad eléctrica de los semiconductores aumenta rápidamente con el aumento de la temperatura, mientras que la conductividad eléctrica de los metales disminuye lentamente con el aumento de la temperatura. Las propiedades de los semiconductores se pueden modificar dopando o introduciendo impurezas. Al agregar un elemento con más electrones de valencia que los átomos del huésped, se llena la banda de conducción, lo que resulta en un semiconductor de tipo n con mayor conductividad eléctrica. Agregar un elemento con menos electrones de valencia que los átomos del huésped genera agujeros en la banda de valencia, lo que resulta en un semiconductor de tipo p que también exhibe mayor conductividad eléctrica.
Llave para llevar
- La unión en metales y semiconductores se puede describir utilizando la teoría de bandas, en la que se genera un conjunto de orbitales moleculares que se extiende por todo el sólido.
Problemas conceptuales
-
¿Se puede aplicar la teoría de bandas a metales con dos electrones en sus orbitales de valencia? sin electrones en sus orbitales de valencia? ¿Por qué o por qué no?
-
Dada una muestra de un metal con 10 20 átomos, ¿cómo se compara el ancho de la banda que surge de las interacciones orbitales p con el ancho de la banda que surge de las interacciones orbitales s? de d interacciones orbitales?
-
El diamante tiene una de las conductividades eléctricas más bajas conocidas. En base a este hecho, ¿espera que el diamante sea coloreado? ¿Por qué? ¿Cómo explica el hecho de que algunos diamantes son de color (como el diamante “rosa” o el diamante “verde”)?
-
¿Por qué los halogenuros de plata, utilizados en la industria fotográfica, tienen huecos de banda típicos de los materiales semiconductores, mientras que los halogenuros de metales alcalinos tienen huecos de banda muy grandes?
-
A medida que aumenta el carácter iónico de un compuesto, ¿aumenta o disminuye su banda prohibida? ¿Por qué?
-
¿Por qué se utiliza el silicio, más que el carbono o el germanio, en la industria de los semiconductores?
-
El carbono es un aislante, y el silicio y el germanio son semiconductores. Explicar la relación entre la configuración electrónica de valencia de cada elemento y sus estructuras de banda. ¿Cuál tendrá la mayor conductividad eléctrica a temperatura ambiente: silicio o germanio?
-
¿Cómo afecta el dopaje a la conductividad eléctrica de un semiconductor? Dibujar el efecto del dopaje en los niveles de energía de la banda de valencia y la banda de conducción tanto para un semiconductor de tipo n como de tipo p.
RESPUESTAS
-
La baja conductividad eléctrica del diamante implica una banda prohibida muy grande, correspondiente a la energía de un fotón de luz ultravioleta en lugar de luz visible. En consecuencia, el diamante debe ser incoloro. Los diamantes rosados o verdes contienen pequeñas cantidades de impurezas altamente coloreadas que son responsables de su color.
-
A medida que aumenta el carácter iónico de un compuesto, la brecha de banda también aumentará debido a una disminución en el solapamiento orbital. Recuerde que la superposición es mayor para orbitales de la misma energía, y que la diferencia de energía entre orbitales en átomos adyacentes aumenta a medida que aumenta la diferencia en electronegatividad entre los átomos. Así, grandes diferencias en la electronegatividad aumentan el carácter iónico, disminuyen el solapamiento orbital y aumentan la brecha de banda.
Problemas numéricos
-
De Ca, N, B y Ge, que convertirán silicio puro en un semiconductor tipo p al dopar? Explica tu razonamiento.
-
De Ga, Si, Br y P, que convertirán el germanio puro en un semiconductor de tipo n al dopar? Explica tu razonamiento.